 Argentina
Argentina Comisión Nacional de Evaluación de Tecnologías Sanitarias y Excelencia Clínica – CONETEC
– Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT)
– Red Argentina de Evaluación de Tecnologías Sanitarias (RedArETS) cuyos nodos miembros son: Ministerio de Salud de Ciudad de Buenos Aires, Ministerio de Salud de la Provincia de Buenos Aires, Ministerio de Salud de la Provincia de Mendoza, Ministerio de Salud de la Provincia de Neuquén, Ministerio de Salud de la Provincia de Río Negro, Ministerio de Salud de la Provincia de Santa Fe, Superintendencia de Servicios de Salud, Hospital El Cruce, Escuela Superior de Sanidad – FBCB / Universidad Nacional del Litoral, Universidad Nacional del Sur, Centro Universitario de Estudios en Salud, Economía y Bienestar de la Universidad Nacional del Comahue, Centro Universitario de Farmacología de la Universidad Nacional de La Plata, Instituto del Corazón de Corrientes, Instituto Nacional del Cáncer, Dirección Nacional de Calidad en Servicios de Salud y Regulación Sanitaria del Ministerio de Salud de la Nación.
– Instituto de Efectividad Clínica y Sanitaria (IECS)
– Centro Universitario de Farmacología de la Universidad Nacional de la Plata (CUFAR – UNLP)
– Instituto de Medicina para la Seguridad Social y Evaluación Tecnológica (IMSSET – UBA).
– Universidad ISALUD (ISALUD)
– Un estudio publicado en 2021 relevó e identificó 39 instituciones que realizan algún tipo de informe de ETS en Argentina. Diagnóstico de situación de la evaluación de tecnologías sanitarias en instituciones del ámbito de la salud en Argentina. Revista Argentina De Salud Pública. Recuperado a partir de: https://rasp.msal.gov.ar/index.php/rasp/article/view/495
 Brasil
Brasil • El país cuenta con un organismo/unidad/comité que lidere y coordine la elaboración de informes de ETS que permiten apoyar la toma de decisiones relativas a la incorporación TS en el sistema público de salud: Sí, Comité Nacional en el Ministerio de Salud
• Nombre del Organismo o agencia pública o programa de ETS a nivel Nacional:
Comisión Nacional de Incorporación de Tecnologías en el Sistema Único de Salud – Conitec
• Otras dependencias nacionales que elaboran informes de ETS:
– Centros de evaluación de tecnologías sanitarias (NATS), que forman parte de la Red Brasilera de Evaluación de Tecnologías de Sanitarias (Rebrats)
– Agencia Nacional de Vigilancia Sanitaria -Anvisa
• Programas de ETS a nivel subnacional: No
• Otros organismos que elaboran informes de ETS en el país:
La Red Brasileña de Evaluación de Tecnologías Sanitarias (Rebrats) se creó en 2008 y es una red de centros públicos y privados – los Centros de evaluación de tecnologías sanitarias (NATS) – que desarrollan productos o informes de evaluación de tecnología sanitaria (ETS). Grupos académicos, hospitales de excelencia, equipos de las secretarias de salud estatales o municipales pueden demandar su afiliación en Rebrats, si realizan capacitaciones, elaboración de estudios de ETS o Guías de Práctica Clínica y brinden información para la toma de decisión en el SUS.
Actualmente, Rebrats cuenta con 80 NATS que tienen conocimientos de ETS en diferentes niveles, desde el nivel básico hasta el avanzado. De estos, 20 tienen una alianza con Conitec para preparar informes de ETS o Guías de Prácticas Clínicas (GPC). Son ellos:
– Centro Cochrane de Brasil
– Centro de Desarrollo Tecnológico en Salud (FIOCRUZ CDTS)
– Centro de Evaluación de Tecnologías Sanitarias – Instituto Sirio-Libanés de Enseñanza e Investigación Hospital Sirio-Libanés
– Hospital de Clínicas de Porto Alegre (HCPA)
– Hospital Alemán Oswaldo Cruz (HAOC)
– Hospital Base del Distrito Federal (HBDF)
– Hospital de Clínicas de la Facultad de Medicina de Botucatu (HCFMB)
– Hospital de Clínicas de la Facultad de Medicina de Ribeirão Preto (HCFMRPUSP)
– Hospital de Clínicas de la Facultad de Medicina de la Universidad de São Paulo (HCFMUSP)
– Hospital de Clínicas de la Universidad Estatal de Campinas (HC UNICAMP)
– Hospital Molinos de Viento (HMV)
– Instituto de Medicina Social de la Universidad Estatal de Río de Janeiro (IMS/UERJ)
– Instituto Nacional de Cardiología (INC)
– Instituto Nacional del Cáncer (INCA)
– Instituto Nacional de Traumatología y Ortopedía (INTO)
– Laboratorio de Salud Basada en Evidencias de la Escuela de Ciencias de la Salud – ESCS (LABSBE)
– Programa de Evidencias para Políticas y Tecnologías Sanitarias (FIOCRUZ PEPTS)
– Universidad Federal de lo Estado de Rio de Janeiro (UNIRIO)
– Universidad Federal do Paraná (UFPR)
– Universidad Federal de São Paulo (UNIFESP)
Además de estos, otros órganos que elaboran informes de ETS en Brasil son:
– Centro Colaborador do SUS para Evaluación de Tecnologías y Excelencia en Salud (CCATES)/ Universidad Federal de Minas Gerais (UFMG)
– Instituto de Ingenieria Biomédica/Universidad Federal de Santa Catarina (IEB/UFSC)*
– Agencia Nacional de Salud Suplementaria (ANS)
 Chile
Chile • El país cuenta con un organismo/unidad/comité que lidere y coordine la elaboración de informes de ETS que permiten apoyar la toma de decisiones relativas a la incorporación TS en el sistema público de salud: Sí, Departamento Nacional en el Ministerio de Salud
• Nombre del Organismo o agencia pública o programa de ETS a nivel Nacional: Departamento de Evaluación de Tecnologías Sanitarias y Salud Basada en Evidencia (ETESA/SBE)
• Otras dependencias nacionales que elaboran informes de ETS: Subdepartamento de Innovación, desarrollo, transferencia tecnológica (I+D+T) y ETESA del Instituto de Salud Pública de Chile
• Programas de ETS a nivel subnacional: Si hay
• Otros organismos que elaboran informes de ETS en el país:
– Unidad ETESA de la Pontífica Universidad católica de Chile, Facultad de Medicina
– Centro de Evidencia – Pontífica Universidad católica de Chile
– Centro de Investigación y Gestión basada en Evidencia (CIGES) – Universidad de la Frontera, Facultad de Medicina
– Escuela de Salud Pública, Universidad de Chile
– Unidad de ETESA – Instituto Oncológico Fundación Arturo López Pérez FALP
– Centro Interdisciplinario de Estudios en Salud – Universidad de Valparaíso
 Costa Rica
Costa Rica • El país cuenta con un organismo/unidad/comité que lidere y coordine la elaboración de informes de ETS que permiten apoyar la toma de decisiones relativas a la incorporación TS en el sistema público de salud: No
• Dependencias nacionales que elaboran informes de ETS:
Caja Costarricense de Seguro Social – Dirección de Farmacoepidemiología
• Programas de ETS a nivel subnacional: No
• Otros organismos que elaboran informes de ETS en el país: No
 Ecuador
Ecuador  El Salvador
El Salvador • El país cuenta con un organismo/unidad/comité que lidere y coordine la elaboración de informes de ETS que permiten apoyar la toma de decisiones relativas a la incorporación TS en el sistema público de salud: Sí, Dirección Nacional en el Ministerio de Salud.
• Nombre del Organismo o agencia pública o programa de ETS a nivel Nacional:
Dirección de Tecnologías Sanitarias – DIRTECS. Unidad de Evaluación de Tecnologías Sanitarias
• Otras dependencias nacionales que elaboran informes de ETS:
Instituto Salvadoreño de Seguridad Social
• Programas de ETS a nivel subnacional: No
• Otros organismos que elaboran informes de ETS en el país: No
 Guatemala
Guatemala – Instituto Guatemalteco de Seguridad Social, Dirección Terapéutica Central
 México
México – Centro Nacional de Excelencia Tecnológica en Salud (CENETEC)
– Instituto Mexicano del Seguro Social (IMSS), División de Evaluación de Tecnologías en Salud.
 Paraguay
Paraguay Comité Nacional de Farmacoterapeútica
 Perú
Perú Red Nacional de Evaluación de Tecnologías Sanitarias – RENETSA
– Unidad de Análisis y Generación de Evidencias en Salud Pública (UNAGESP), Centro Nacional de Salud Pública, Instituto Nacional de Salud (INS)
– Dirección General de Medicamentos, Insumos y Drogas (DIGEMID), Ministerio de Salud de Perú
– Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI), Seguro Social de Salud (ESSALUD)
– Unidad Funcional de Evaluación de Tecnologías Sanitarias (UFETS), Instituto Nacional de Enfermedades Neoplásicas (INEN)
 República Dominicana
República Dominicana  Uruguay
Uruguay Agencia de Evaluación de Tecnologías Sanitarias del Uruguay (AETSU)
– Departamento de Evaluación de Tecnología, Ministerio de Salud Pública
– Programa Nacional de Control del Cáncer Programa nacional de control del cáncer, Ministerio de Salud Pública
– Banco de Previsión Social (Suscripción de convenios con organismos)
– Dirección Nacional de Sanidad de las Fuerzas Armadas, Comisión de Evaluación de Tecnologías Médicas
– Unidad Académica de Evaluación de Tecnologías del Departamento de Medicina Preventiva y Social, Facultad de Medicina, Universidad de la República
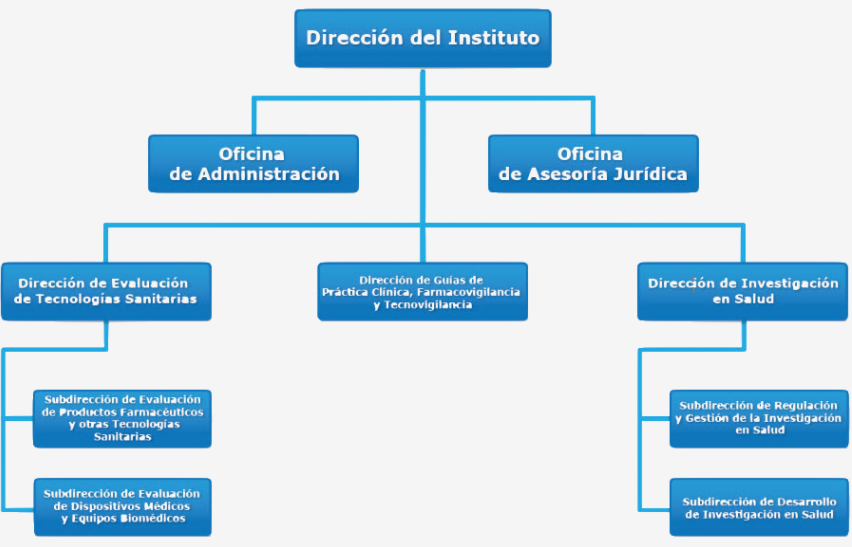
 Argentina
Argentina En el 2018 por Resolución Ministerial de Salud N º 623 se crea en el ámbito del Ministerio de SaludNacional, dependiente de la Unidad de Coordinación General del mismo, la Comisión Nacional de Evaluación de Tecnologías Sanitarias (CONETEC). Las funciones inherentes a la Coordinación General de CONETEC se asignan al titular de la Unidad de Coordinación General del Ministerio de salud, y como Coordinador Operativo de la misma, al Secretario de Coberturas y Recursos de Salud.
Mediante el Decreto N°344 de 2023, la CONETEC es un nuevo organismo desconcentrado del Ministerio de Salud Nacional, donde sus recomendaciones ahora tienen carácter vinculante para este Ministerio y sus organismos descentralizados y desconcentrados, manteniendo la perspectiva de su análisis y alcance para los tres subsectores. La Comisión estará integrada por un representante designado por el Ministerio de Salud, un representante designado por el Consejo Federal de Salud (Co.Fe.Sa.), un representante designado por la Superintendencia de Servicios de Salud y un representante de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT). También se a invitar a formar parte de la Comisión Nacional de Evaluación de Tecnologías de Salud, con “carácter ad honorem”, a un representante por el Instituto Nacional de Servicios Sociales para Jubilados y Pensionados (INSSJP), un representante por las Obras Sociales Nacionales, un representante por las Obras Sociales Provinciales, un representante por las Entidades de Medicina Prepaga, un representante por las asociaciones de pacientes y un representante por la Defensoría del Pueblo de la Nación.
 Brasil
Brasil La Comisión Nacional para la Incorporación de Tecnologías en el Sistema Único de Salud – Conitec fue creada mediante la Ley nº 12.401, de 28 de abril de 2011. La misma, prevé la asistencia terapéutica y la incorporación de tecnologías sanitarias en el ámbito del Sistema Único de Salud.
La Conitec, asistida por el Departamento de Gestión e Incorporación de Tecnologías e Innovación en Salud – DGITIS del Ministerio de Salud nacional, tiene como objetivo asesorar al Ministerio de Salud en las atribuciones relativas a la incorporación, exclusión o cambio de tecnologías sanitarias por parte del SUS, así como en la constitución o cambio de protocolo clínico o pauta terapéutica.
El nuevo marco legal trajo mayor agilidad, transparencia y eficiencia en el análisis de los procesos de incorporación de tecnología, con un plazo de 180 días (prorrogable por otros 90 días) para la toma de decisiones. Por ley, el análisis debe basarse en evidencia científica, tomando en cuenta aspectos como la eficacia, exactitud, efectividad y seguridad de la tecnología, además de la evaluación económica comparativa de los beneficios y costos en relación con las tecnologías existentes. La ley también establece el requisito de registro previo del producto ante la Agencia Nacional de Vigilancia Sanitaria – Anvisa para que pueda ser evaluado para su incorporación al Sistema Único de Salud. Además de este registro, en el caso de los medicamentos, también es necesario contar con el precio máximo de venta aprobado por la Cámara de Regulación del Mercado de Medicamentos – CMED.
Para regular el funcionamiento de la Comisión se publicó el Decreto No. 7.646, de 21 de diciembre de 2011.
La DGITIS fue creada mediante Decreto N ° 7.797, del 30 de agosto de 2012, derogado por Decreto N ° 9.795 / 2019, reformado por Decreto N ° 9.816 / 2019, y es responsable de monitorear, subsidiar y apoyar las actividades y demandas del Conitec y contribuir a la promoción del acceso y uso racional de tecnologías seguras y eficientes, entre otros.
Para mayor información: http://conitec.gov.br/legislacao; http://conitec.gov.br/historico-institucional
 Chile
Chile La estructura actual del Departamento se configura a través de la Resolución Ministerial de Salud Nº 707 del año 2017, que crea el Departamento de Evaluación de Tecnologías Sanitarias y Salud basada en la Evidencia (ETESA/SBE), dependiente de la División de Planificación Sanitaria, dentro de la Subsecretaría de Salud Pública del Ministerio de Salud. El departamento de ETESA/SBE es el resultado de la fusión del antiguo Departamento de Evaluación de Tecnologías Sanitarias, de la División de Planificación Sanitaria y del Departamento de Salud Basada en Evidencia y Garantías Sanitarias, de la División de Prevención y Control de Enfermedades.
El objeto del Departamento de ETESA/SBE es la provisión y análisis de la mejor evidencia disponible para la toma de decisiones en salud, a nivel de política pública, de sistemas de salud, de decisiones de cobertura y de recomendaciones clínicas.
Dentro de las funciones transversales del Departamento se encuentran las de generar metodologías comparables y transparentes para la definición de intervenciones sanitarias que otorgan beneficio en forma equitativa en el contexto de recursos limitados y en un entorno sociocultural determinado; apoyar metodológicamente a los departamentos del Ministerio de Salud; fortalecer competencias técnicas de los funcionarios del Ministerio de Salud para la elaboración y actualización de productos basados en evidencia; generar instancias de extensión y difusión de ETESA y Guías de Práctica Clínica y realizar búsqueda y análisis de evidencia sobre intervenciones propuestas para el sistema de protección financiera de la Ley 20.850, para el régimen Garantías Explícitas en Salud GES u otras según solicitud de la Autoridad.
 Costa Rica
Costa Rica A partir del Decreto Ejecutivo Nº 19343-S se crea un Comité Técnico (Comité Central de Farmacoterapia de la Caja Costarricense de Seguro Social) como organismo auxiliar y asesor del Ministerio de Salud para la actualización del Formulario Terapéutico Nacional.
Serán atribuciones y funciones del Comité las siguientes:
1) Realizar los estudios científicos necesarios para la revisión y actualización del Formulario Terapéutico Nacional.
2) Analizar periódicamente las estadísticas de morbilidad, a fin de determinar si se han producido cambios que justifiquen la revisión de los productos de primera elección incluidos en el Formulario Terapéutico Nacional.
3) Recomendar a las instituciones del Sector Público de Salud, las normas generales sobre la prescripción de medicamentos, conforme con las estructuras y decisiones internas de cada institución, especialmente en lo tocante a la cantidad de medicamentos a recetar, al personal idóneo para la prescripción de cada producto y al procedimiento para hacer sustituciones dentro del grupo farmacológico correspondiente, así como a las medidas para resolver casos excepcionales.
4) Hacer estudios sobre la utilización de medicamentos en relación con la morbilidad.
5) Prestar asesoramiento a quien corresponda en materia de controles de calidad y producción de medicamentos.
6) Ordenar, realizar o coordinar estudios especiales sobre medicamentos.
7) Proporcionar información en el campo de la terapéutica, especialmente en cuanto a indicaciones, contraindicaciones, precauciones especiales, efectos adversos, duración del tratamiento, dosis pediátricas y de adultos, y otros temas atinentes.
8) Promover programas de divulgación al público y al personal del Sector Público de Salud, sobre el Formulario Terapéutico Nacional utilizando los medios de comunicación social.
9) Sugerir a las instituciones públicas de salud, normas sobre la promoción de medicamentos, inclusive en el campo de la visitaduría médica.
10) Realizar estudios de costo-beneficio en cuanto a la implementación del Formulario Terapéutico Nacional, dentro de una política de coordinación de normas y procesos de compras y suministros, con el fin de reducir tales costos.
Reglamento interno del Comité disponible aquí.
La Dirección de Farmacoepidemiología de la Caja Costarricense de Seguro Social (CCSS) produce informes de ETS que apoyan la toma de decisiones de cobertura de fármacos por parte del Comité Central de Farmacoterapia.
En diciembre de 2019 se creó en la CCSS la Dirección de Evaluación de Tecnologías Sanitarias, adscrita a la Gerencia General, que incorporaría también la evaluación de Dispositivos Médicos.
 Ecuador
Ecuador La Dirección Nacional de Inteligencia en Salud (ex Proceso de Ciencia y Tecnología) depende de la Coordinación General de Desarrollo Estratégico en Salud (CGDES). La CGDES inició su operación en febrero de 2012 a fin de apoyar las decisiones de las autoridades sanitarias del MSP, facilitando información técnica estratégica referida a las consecuencias impacto de las acciones del sector sobre el estado de la salud de la población.
De conformidad con el Estatuto Orgánico Sustitutivo de Gestión Organizacional por Procesos de Ministerio de Salud Pública del Ecuador, emitido mediante Acuerdo Ministerial Nro. 00004520, publicado en Registro Oficial Edición Especial Nro. 118 del 31 de marzo de 2014 y modificado el 19 octubre de 2017”, la Dirección Nacional de Inteligencia de la Salud tiene como misión “Generar información para la formulación de políticas, lineamientos estratégicos y normativa de fortalecimiento de la gestión de la Autoridad Sanitaria Nacional, en los campos referidos a evaluación de tecnología sanitaria e investigaciones en salud.”
Adicionalmente a través de Acuerdo Ministerial Nro. 0158-A publicado en el Registro Oficial Nro. 160 del 15 de enero de 2018 se emitió el “Reglamento sustitutivo para autorizar la adquisición de medicamentos que no constan en el Cuadro Nacional de Medicamentos Básicos – CNMB vigente”, mismo que tiene como objetivo normar el procedimiento para solicitar, evaluar y autorizar la adquisición y el uso de medicamentos que no constan en el Cuadro Nacional de Medicamentos Básicos – CNMB vigente, en los casos de emergencia y en el tratamiento de enfermedades catastróficas; enfermedades raras y otras de baja prevalencia en las cuales se hayan agotado o no sea posible utilizar todas las alternativas terapéuticas disponibles en el CNMB; a través del cual se establece que la Dirección Nacional de Inteligencia de la Salud y a la Dirección Nacional de Economía de la Salud emitan informes técnicos que evalúen la eficacia, seguridad y análisis fármaco-económico de medicamentos que no forman parte del CNMB, respectivamente.
 El Salvador
El Salvador En el 2020 se regula la organización del Nivel Superior del Ministerio de Salud, y se vuelve necesaria la actualización de los manuales administrativos de cada una de las dependencias por lo cual se escribe un Nuevo Manual de organización para las funciones de la DIRTECS. En el mismo se establece la dependencia jerárquica de la Dirección de Tecnologías Sanitarias con el Viceministerio de Gestión y Desarrollo en Salud y la actuación de la misma como la dependencia técnica especializada en el área de tecnologías sanitarias del Ministerio de Salud responsable de normar y operativizar el acceso oportuno y uso racional de tecnologías para asegurar su calidad, seguridad y eficacia en el campo de la salud.
Los procesos que involucran a la dirección son los siguientes:
– Evaluar e implementar las tecnologías sanitarias
– Investigar, desarrollar e innovar en salud.
 Guatemala
Guatemala Si bien no existe en las esferas del Ministerio de Salud Pública y Asistencia Social de Guatemala un organismo que realice ETS, existe dicha figura en el subsector de la seguridad social dentro del Instituto Guatemalteco de Seguridad Social (IGSS).
En abril de 2018 mediante el Acuerdo Número 1418 del IGSS se creó la Dirección Terapéutica Central dependiente de la Subgerencia de Prestaciones de Salud. La misma tiene como finalidad realizar las investigaciones científicas pertinentes para lograr una efectiva selección, utilización, monitoreo y eficacia de los medicamentos y dispositivos médicos necesarios y adecuados para la atención de los afiliados y derechohabientes del IGSS.
 México
México El Centro Nacional de Excelencia Tecnológica en Salud (CENETEC), es un órgano desconcentrado de la Secretaría de Salud, su creación se formalizó el 19 de enero de 2004, mediante la publicación en el Diario Oficial de la Federación del Reglamento Interior de la Secretaría de Salud, en donde se reforma el artículo 41, para establecer las atribuciones del CENETEC:
I. Difundir de forma sistemática y objetiva información sobre dispositivos médicos, telesalud, guías de práctica clínica y evaluación de tecnologías para la salud, con el fin de promover su uso apropiado, seguro y eficiente como instrumento para la toma de decisiones en beneficio de la población y la excelencia en la práctica clínica;
II. Establecer convenios y coordinar actividades con centros colaboradores de tecnologías para la salud donde participen instituciones del sector salud de la comunidad científica, académica y empresarial que tengan por objeto impulsar la modernización, innovación, excelencia y desarrollo de tecnologías para la salud apropiadas a las necesidades del país;
III. Establecer coordinación permanente con los organismos nacionales e internacionales dedicados a los dispositivos médicos, guías de práctica clínica, telesalud y evaluación de tecnologías en salud para el intercambio de información y participación continua;
IV. Generar e integrar lineamientos en materia de equipamiento médico, para apoyar su incorporación, uso, mantenimiento, reemplazo y baja técnica, así como asesorar en esta materia a las unidades que lo soliciten;
V. Generar, integrar y actualizar el Plan Maestro de Equipamiento, para apoyar el proceso de planeación y gestión de equipo médico en unidades médicas, promoviendo el uso de tecnologías apropiadas y la integración de redes de servicio de atención a la salud, favoreciendo la accesibilidad, calidad de la atención y la optimización de los recursos;
VI. Promover el desarrollo de áreas de ingeniería biomédica a nivel estatal, regional e institucional para optimizar la gestión de tecnología biomédica;
VII. Generar, recopilar y difundir información técnica sobre equipo médico para apoyar la toma de decisiones en cuanto a su incorporación, uso y aplicación;
VIII. Elaborar, establecer y difundir los lineamientos nacionales de infraestructura tecnológica, políticas y procesos para incorporar y desarrollar los servicios de telesalud dentro del Sistema Nacional de Salud con el fin de favorecer la integración de redes y para coadyuvar a la equidad, accesibilidad y calidad en los servicios de salud en coordinación con las áreas competentes de la Secretaría de Salud;
IX. Establecer mecanismos para elaborar, difundir e integrar la información técnica y estándares en materia de intercambio de información entre la tecnología biomédica y las aplicaciones de telesalud de conformidad con las disposiciones aplicables;
X. Conducir la aplicación, adopción y uso de los servicios de telesalud dentro del Sistema Nacional de Salud, apoyando la incorporación de las tecnologías telemáticas relacionadas con los servicios de atención médica;
XI. Establecer en consenso con las instituciones del Sistema Nacional de Salud, la metodología para elaborar las guías de práctica clínica, promover y coordinar su integración, recopilarlas y difundirlas con el objeto de orientar la toma de decisiones de los prestadores y usuarios de servicios de salud;
XII. Emitir los dictámenes y certificados de necesidad de equipo médico en concordancia con los programas y planes maestros vigentes;
XIII. Realizar y coordinar las evaluaciones de tecnologías en salud, como una herramienta para la mejora en la prestación de los servicios de salud, y
XIV. Proponer y gestionar en coordinación con la Dirección General de Programación, Organización y Presupuesto, ante las instancias competentes, el monto de los derechos, productos y aprovechamientos que se cobren por los servicios que presta el Centro en los términos que determinen las leyes aplicables.
Con fecha 19 de agosto del 2020 se publicó en el Diario Oficial de la Federación el ACUERDO por el que se adscriben orgánicamente las unidades administrativas y órganos desconcentrados de la Secretaría de Salud, mediante el cual CENETEC queda adscrito a la Unidad de Análisis Económico.
Por su parte, el Instituto Mexicano del Seguro Social (IMSS), creó en 2021 la División de Evaluación de Tecnologías en Salud, dependiente de la Unidad de Innovación de la Dirección de Prestaciones Médicas del IMSS. Sus funciones se encuentran establecidas en el Manual de Organización de la Dirección de Prestaciones Médicas.
 Paraguay
Paraguay Al momento el país no cuenta con un proceso oficial de recolección de evidencia y elaboración de ETS como insumo para la toma de decisiones de cobertura de salud pero se encuentra en proceso. Si se cuenta con un Comité Nacional de Farmacoterapia que ya existía pero a partir de mediados de 2019 se reactivó. El comité estará encargado de actualizar la Lista de Medicamentos Esenciales (LME) y del Listado de Insumos Médicos Esenciales (LIME). La Dirección General de Gestión de Insumos Estratégicos del Ministerio de Salud Pública y Bienestar Social es la dependencia encargada de coordinar las actividades de revisión y actualización de los listados esenciales y por ende del Comité.
 Perú
Perú En abril de 2020 por Resolución Ministerial Nº 190-2020 se conforma la Red Nacional de Evaluación de Tecnologías Sanitarias (RENETSA) integrada por:
– El Instituto Nacional de Salud (INS), a través del Centro Nacional de Salud Pública (CNSP),
– La Dirección General de Medicamentos, Insumos y Drogas (DIGEMID), y
– El Seguro Social de Salud (ESSALUD), a través del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI)
Para mayor información: https://www.gob.pe/institucion/minsa/normas-legales/473552-190-2020-minsa
– El Centro Nacional de Salud Pública (CNSP) es el órgano de línea del Instituto Nacional de Salud, encargado de normar, desarrollar, evaluar y difundir de manera integral la investigación en salud pública y las tecnologías apropiadas, para la prevención y el control de las enfermedades transmisibles y no transmisibles, aportando criterios técnicos para la formulación de políticas que orienten la atención de salud en el área de su competencia. La Unidad de Análisis y Generación de Evidencias en Salud Pública (UNAGESP) fue creada en el año 2009 en el Centro Nacional de Salud Pública. Su función principal es contribuir, mediante la investigación, a la toma de decisiones e implementación de políticas públicas en salud basadas en la mejor evidencia científica. Con ello, la UNAGESP brinda soporte en evidencias a los decisores institucionales, del Ministerio de Salud e inclusive otros ministerios y órganos de gobierno.
– La Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) es un órgano de línea del Ministerio de Salud, creado con el Decreto Legislativo Nº 584 del 18 de Abril del año 1990. La DIGEMID es una institución técnico normativa que tiene como objetivo fundamental, lograr que la población tenga acceso a medicamentos seguros, eficaces y de calidad y que estos sean usados racionalmente. Para mayor información visite: https://www.digemid.minsa.gob.pe/institucion
– El Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) es el órgano desconcentrado del Seguro Social de Salud – ESSALUD, responsable de la evaluación económica, social y sanitaria delas tecnologías sanitarias para su incorporación, supresión, utilización o cambio en la institución, así como de proponer las normas y estrategias para la innovación científico tecnológica, la promoción y regulación de la investigación científica en el campo de la salud que contribuyan al acceso y uso racional de tecnologías en salud basada en evidencias de eficacia, seguridad y costo efectividad a ser utilizadas por la Red Prestadora de servicios de salud de ESSALUD en el ámbito nacional. Depende jerárquicamente de la Gerencia General de ESSALUD. Para mayor información visite: http://www.essalud.gob.pe/transparencia/pdf/rof/rof_IETSI.pdf
La coordinación de la RENETSA está a cargo del Instituto Nacional de Salud a través del Centro Nacional de Salud Pública.
– La Unidad Funcional de Evaluación de Tecnologías Sanitarias del Instituto Nacional de Enfermedades Neoplásicas (UFETS – INEN) fue creada el 15 de enero del 2020 bajo Resolución Jefatural N°020-2020-J/INEN, es responsable de la evaluación de aquellas tecnologías sanitarias incluyendo medicamentos, dispositivos y equipos médicos, procedimientos médicos o quirúrgicos y sistemas de organización requeridas por órganos usuarios que sean nuevas para la entidad y no cuenten con cobertura financiera de la/s IAFAS, así como aquellas tecnologías sanitarias ya existentes en la entidad. Considerando aspectos de seguridad, efectividad clínica, costo – efectividad, eficiencia e impacto económico en el INEN.
 República Dominicana
República Dominicana Al momento el país no cuenta con un proceso oficial de recolección de evidencia y elaboración de ETS como insumo para la toma de decisiones de cobertura de salud.
Desde la Superintendencia de salud y riesgos laborales (SISALRIL) se está iniciando un proceso para el desarrollo de la ETS en la institución, ya que es el órgano técnico responsable de presentar propuestas para al Consejo Nacional de la Seguridad Social para la actualización del Catálogo de Prestaciones (sea mediante inclusión, o mediante exclusión de tecnologías).
La SISALRIL es una entidad estatal autónoma con personería jurídica y patrimonio propio que ejerce las funciones establecidas en la Ley de Seguridad Social y sus normas complementarias para proteger los intereses de los afiliados, vigilar la solvencia financiera de las Administradoras de Riesgos de Salud (ARS), supervisar el pago puntual a dichas administradoras y de éstas a los prestadores de servicios de salud y contribuir a fortalecer el Sistema Nacional de Salud.
 Uruguay
Uruguay Desde 2007 Uruguay comenzó su desarrollo en ETS en el Ministerio de Salud Pública. En junio del 2018 por Decreto Nacional 178/018 se crea la Unidad Especializada de Evaluación de Tecnologías Sanitarias, dependiente de la División Evaluación Sanitaria de la Dirección General de la Salud del Ministerio de Salud Pública. Hasta 2020 la evaluación de ETS en Uruguay, se encontró en la égida de la División Evaluación Sanitaria de la Dirección General de la Salud del Ministerio de Salud Pública. El 9 de julio de 2020, de acuerdo con lo dispuesto por el artículo 407 de la Ley N.º 19.899, se crea la Agencia de Evaluación de Tecnologías Sanitarias de Uruguay. En la Ley N°19.924 de Presupuesto Nacional se aprueba su organización y presupuesto a través de los artículos 403 al 422. Posteriormente, el Decreto 241/021 reglamenta al organismo, y el 26 de junio de 2023 se ajusta la reglamentación a las necesidades operativas de la Agencia.
El 12 de junio de 2023, el reglamento interno del Ministerio de Salud Pública actualiza el proceso de incorporación de especialidades farmacéuticas, dónde establece que los informes técnico para avalar la incorporación de nuevos medicamentos al Formulario Terapéutico de Medicamentos o bajo la cobertura financiera del FNR pueden ser realizados por aquellas instituciones que el Ministerio de Salud Pública autorice, y reconoce a la Agencia de ETS como institución idónea para brindar informes técnicos de eficacia y seguridad, o estudios de evaluación económica necesarios. En la Ley de Presupuesto Nacional de 2023, se autoriza a AETSU a acceder a las bases de datos de la historia clínica electrónica.
AETSU es una persona jurídica de derecho público no estatal que tiene a su cargo la evaluación de las Tecnologías Sanitarias acorde a la política que establece el Poder Ejecutivo.
El contralor administrativo de la Agencia es ejercido por el Poder Ejecutivo a través del Ministerio de Salud Pública (MSP). Entre sus potestades le cabe designar al Gerente General y controlar la ejecución del presupuesto asignado. Por este motivo, La Agencia presenta su presupuesto anual y compromiso de gestión ante el MSP, pero en ningún caso éste interfiere con la autonomía e independencia técnica de los dictámenes realizados por la Agencia.
Compete a la Agencia de Evaluación de Tecnologías Sanitarias:
a) Recabar, evaluar y analizar información relacionada con tecnologías sanitarias.
b) Generar evidencia científica e información clínica, económica y de gestión relacionada con las tecnologías sanitarias, a través de investigaciones a nivel nacional e internacional.
c) Adoptar criterios de eficacia, efectividad, eficiencia, seguridad, equidad y calidad en su s investigaciones.
d) Brindar capacitación y asesoramiento a todos los organismos públicos que lo requieran y a instituciones privadas dedicadas a la prestación de servicios de educación, salud e investigación científico – sanitaria.
e) Contribuir en la capacitación y formación del personal sanitario en aspectos relacionados con la investigación e interpretación de las tecnologías sanitarias.
f) Asesorar a las autoridades estatales en la toma de decisiones cuando le sea requerido y en lo pertinente a su especialidad, basándose en criterios objetivos y eficientes centrados en el usuario, así como en lo relacionado a la adopción de prácticas clínicas, tecnológicas y políticas de salud.
g) Relacionarse con otras agencias de evaluación de tecnología sanitaria internacionales.
 Argentina
Argentina La CONETEC está integrada por representantes de los siguientes organismos e instituciones:
– Ministerio de Salud de la Nación, que ejerce además la Coordinación a través de la Subsecretaría de Medicamentos e Información Estratégica y de sus asesores,
– Consejo Federal de Salud (COFESA),
– Superintendencia de Servicios de Salud (SSS),
– Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT),
– Instituto Nacional de Servicios Sociales para Jubilados y Pensionados (INSSJP),
– Defensoría del Pueblo de la Nación,
– Obras Sociales Nacionales (OSN),
– Obras Sociales Provinciales (COSSPRA),
– Entidades de Medicina Prepaga (EMP),
– Asociaciones de Pacientes.
Estructura y flujo de trabajo de la CONETEC:
1) Dirección ejecutiva de la CONETEC en el Ministerio de Salud Nacional.
2) Mesa de pacientes:
3) Mesa de priorización: 10 (diez) integrantes.
4) Mesa técnica: 13 (trece) integrantes.
5) Mesa de recomendaciones: 10 (diez) integrantes.
7) Mesa de investigadores: Integrada por organismos o instituciones académicas de ETS independientes, entre ellos: investigadores/as de la CONETEC, de la Red Argentina Pública de Evaluación de Tecnologías Sanitarias (RedARETS), de la universidad (ISALUD), del Instituto de Efectividad Clínica y Sanitaria (IECS), del Centro Universitario de Farmacología de la Universidad Nacional de La Plata (CUFARUNLP), del Instituto de Medicina para la Seguridad Social y Evaluación Tecnológica de la Universidad de Buenos Aires (IMSSET-UBA), y otros que en el futuro expresen su voluntad de participar.
Otros actores de interés: Actores externos a las Mesas de Trabajo que pueden ser instituciones académicas, pacientes y personas a cargo de su cuidado (pacientes con experiencia, representantes de organizaciones de pacientes, pacientes individuales, cuidadores, y defensores pacientes), sociedades y organizaciones de profesionales de la salud, profesionales individuales, y productores de tecnologías.
La participación de todos los integrantes en la CONETEC es con carácter “ad honorem” y adaptada a los diferentes espacios de interacción donde sus aportes sean requeridos.
La CONETEC no cuenta con un presupuesto propio asignado, depende del presupuesto del Ministerio de Salud de la Nación.
Para mayor información: https://www.argentina.gob.ar/salud/conetec/documentos-tecnicos
 Brasil
Brasil La estructura operativa del Conitec está compuesta por dos foros: el Plenario y la Secretaría Ejecutiva:

El Plenario es el foro encargado de emitir una recomendación sobre la incorporación, exclusión o cambio de tecnologías dentro del SUS, sobre la constitución o cambio de Guías de Práctica Clínica y actualización del Listado Nacional de Medicamentos Esenciales – Rename, que fue establecido por Decreto no. ° 7.508, de 28 de junio de 2011.
La Secretaria Ejecutiva es ejercida por el DGITIS, y es responsable de la gestión y coordinación de las actividades de la Comisión, así como la emisión de informes técnicos sobre la tecnología evaluada, tomando en cuenta la evidencia científica, la evaluación económica y el impacto presupuestario (entre otros) de incorporar la tecnología al Sistema Único de Salud.
Oficialmente, el DGITIS está integrado por dos Coordinaciones Generales: la Coordinación General de Innovación Tecnológica en Salud – CGITS y la Coordinación General de Gestión de Tecnologías Sanitarias – CGGTS. El CGGTS está bajo la dirección de la Coordinación de Evaluación y Monitoreo de Tecnologías Sanitarias – CMATS; Coordinación de Incorporación de Tecnología – CITEC; Coordinación de Gestión de Protocolos Clínicos y Guías Terapéuticas – CPCDT.
Sin embargo, ante la necesidad de monitorear la efectividad de las tecnologías incorporadas y, en el futuro, evaluar su desempeño, se estableció un grupo técnico específico para tratar el tema. Por lo tanto, DGITIS ha estado invirtiendo en la reorganización de su estructura. En este sentido, se desarrolló un nuevo organigrama con el fin de optimizar los procesos de trabajo en el contexto actual.
Así, DGITIS cuenta ahora con asistencia técnica que orienta las acciones de las cinco coordinaciones: Coordinación General de Evaluación de Tecnologías Sanitarias – CGATS (esta coordinación incluye la Rebrats); Coordinación de Gestión de Protocolos Clínicos y Guías Terapéuticas – CPCDT; Coordinación de Incorporación de Tecnologías – CITEC; Coordinación de Monitoreo de Tecnologias em Saúde – CMTS; Coordinación General de Innovación Tecnológica em Salud – CGITS.
Estructura del Departamento de Gestión e Incorporación de Tecnologías e Innovación en Salud – DGITIS:
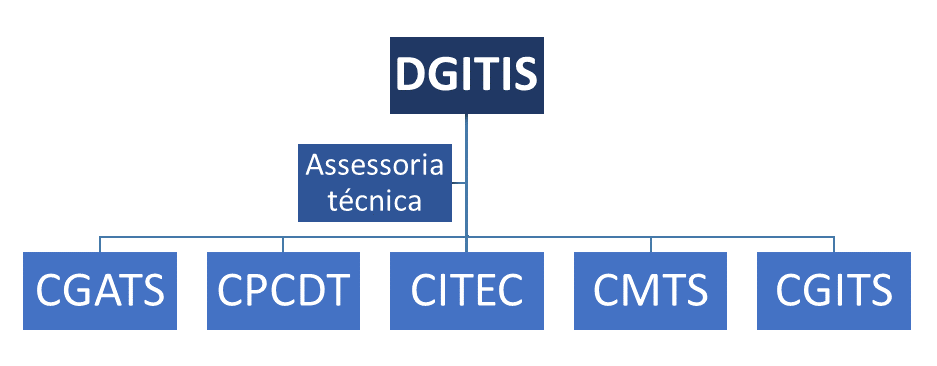
La participación de todos los integrantes en la Conitec es con carácter ad honorem y adaptada a los diferentes espacios de interacción donde sus aportes sean requeridos.
Presupuesto: La Conitec cuenta con un presupuesto propio asignado.
Para mayor información: http://conitec.gov.br/entenda-a-conitec-2
 Chile
Chile El Departamento de Evaluación de Tecnologías Sanitarias y Salud Basada en Evidencia (ETESA/SBE) está estructurado en tres unidades disciplinarias interdependientes con una dotación total de 21 profesionales especializados en la temática:
» Unidad de Evidencia Clínica
Las funciones específicas son liderar y coordinar la elaboración y actualización de Guías de Práctica Clínica (GES y no GES), con énfasis en sus componentes metodológicos y de uso de la mejor evidencia científica disponible, elaborar y actualizar Protocolos de Atención de la Ley 20.850, desarrollar Orientaciones de Manejo Clínico y Protocolos de Atención según solicitud de la Autoridad, desarrollar y mantener plataformas de educación e información respecto a Guías de Práctica Clínica y evaluar el proceso de elaboración, actualización y difusión de las Guías de Práctica Clínica para mejora continua.
» Unidad de Evaluaciones Económicas
Las funciones específicas son desarrollar y actuar como contraparte en las evaluaciones económicas en relación a intervenciones sanitarias, que apoyen la toma de decisiones de cobertura o la formulación de recomendaciones, apoyar técnicamente la elaboración de Guías de Práctica Clínica en materias de uso de recursos e implementación de las recomendaciones, desarrolla un registro de decisiones de cobertura e incorporación de nuevas tecnologías en los distintos programas e instancias de asignación de recursos en salud e impulsar el proceso de implementación de la evaluación de tecnologías sanitarias como política pública.
» Unidad de Políticas de Salud Informadas por Evidencia
Las funciones específicas son utilizar la mejor evidencia científica disponible para crear productos oportunos que puedan informar las decisiones en el proceso de formulación e implementación de políticas de salud, promover la práctica de uso sistemático de la evidencia en el proceso de formulación e implementación de políticas de salud y promover colaboración entre tomadores de decisión, investigadores y organizaciones de la sociedad civil para fomentar el uso de evidencia científica en el proceso de las políticas públicas de salud.
El departamento de ETESA/SBE cuenta con un presupuesto propio asignado anualmente.
 Costa Rica
Costa Rica El Comité Central de Farmacoterapia está integrado en la siguiente forma:
1) El Ministro de Salud o su delegado, quien lo presidirá
2) Un representante de la Caja Costarricense de Seguro Social
3) Un representante del Instituto Nacional de Seguros
4) Un representante del Colegio de Médicos y Cirujanos
5) Un representante del Colegio de Farmacéuticos
6) Un farmacólogo
7) Un experto en administración de servicios de salud.
La Dirección de Farmacoepidemiología de la CCSS cuenta con dos áreas operativas: Área de Medicamentos y Terapéutica Clínica y Área de Fármaco-economía. Se dispone de 7 médicos evaluadores, 2 economistas y 4 farmacéuticos, que tienen otras funciones, además del desarrollo de ETS.
 Ecuador
Ecuador La Coordinación General de Desarrollo Estratégico en Salud (CGDES) está conformada por la Dirección de Ecnonomía en Salud y la Dirección de Inteligencia en Salud.
Dentro de la Dirección Nacional de Inteligencia en Salud existen 3 gestiones internas:
– Evaluación de Tecnología Sanitaria (ETS)
– Investigación y Análisis
– Estudios Sectoriales Transversales
Relativo a la gestión interna de ETS los productos esperados para la Dirección son:
Presupuesto: La dirección no cuenta con un presupuesto propio asignado, depende del presupuesto del Ministerio de Salud Pública de la Nación.
 El Salvador
El Salvador La DIRTECS está integrada por:
– Unidad Asesora: Comité farmacoterapéutico institucional
– Unidades Técnicas:
A. Unidad de Evaluación de Tecnologías Sanitarias.
B. Unidad de Uso Racional de Tecnologías Sanitarias.
C. Unidad de Aseguramiento de la Calidad/ Laboratorio de Control de Calidad.
D. Centro Nacional de Farmacovigilancia.
E. Unidad de Gestión de Equipo Biomédico.
Además, se cuenta con un comité Farmacoterapeútico de apoyo.
Estructura organizativa de la DIRTECS:
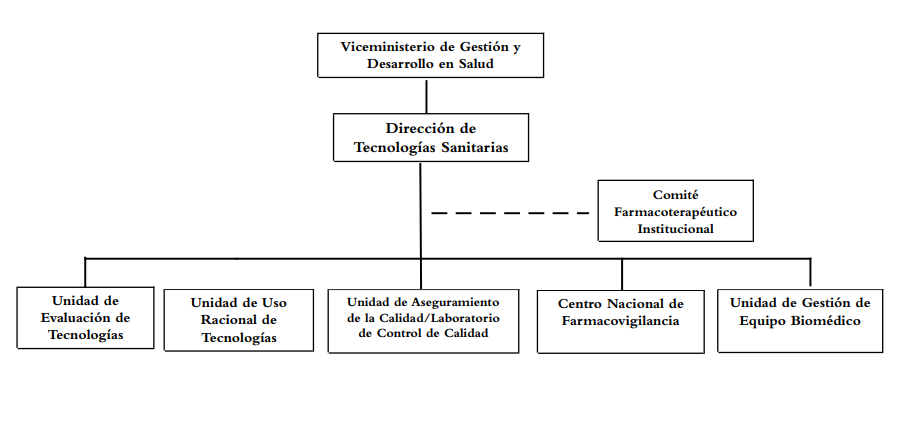
La Unidad de ETS tiene como objetivo desarrollar, proponer e implementar la evaluación de tecnologías sanitarias en los establecimientos de salud del Ministerio para coordinar la inclusión o exclusión de medicamentos y otras tecnologías sanitarias en los listados oficiales competentes a la DIRTECS.
La DIRTECS y la Unidad de ETS no cuentan con un presupuesto propio asignado, depende del presupuesto del Ministerio de Salud de la Nación.
 Guatemala
Guatemala La Dirección Terapéutica Central del IGSS está conformada por cuatro departamentos funcionales:
– Departamento de Farmacoterapia
– Departamento de Farmacovigilancia
– Departamento de Farmacoeconomia
– Departamento de Dispositivos Médicos
La Dirección cuenta con un Talento Humano idóneo para sus tareas de 21 personas.
La Dirección Terapéutica Central tiene las siguientes funciones:
La Dirección cuenta con presupuesto propio asignado.
 México
México El Centro Nacional de Excelencia Tecnológica en Salud (CENETEC) proporciona información basada en la mejor evidencia disponible para una adecuada toma de decisiones en materia de Tecnologías para la salud, en los servicios de salud en México.
Estructura:
El Centro Nacional de Excelencia Tecnológica en Salud, en su Manual de Organización Específico (2020), cuenta con cuatro líneas estratégicas de trabajo: Evaluación de Tecnologías para la salud, Integración de Guías de Práctica Clínica, Ingeniería Biomédica y Telesalud, su estructura organizacional está conformada por 4 direcciones de área, una para cada línea estratégica y una Subdirección de Administración, cuenta con 61 plazas distribuidas en las áreas que lo conforman:
– Dirección de Evaluación de Tecnologías de Salud tiene como objetivo, conducir la integración de información sobre evaluaciones de tecnologías sanitarias (medicamentos, vacunas, dispositivos médicos, intervenciones clínicas y de salud pública), a través del análisis de su efectividad, seguridad, costo-efectividad y, en su caso, de los aspectos éticos y sociales, con el fin de contribuir a mejorar la atención a la salud y al uso óptimo de los recursos.
– Dirección de Integración de Guías de Práctica Clínica tiene como objetivo, conducir la integración, clasificación y difusión de las Guías de Práctica Clínica (GPC), de una manera coordinada y ordenada en la Secretaría de Salud y en el sector salud, a través de una metodología que permita poner a disposición del personal en salud la evidencia disponible que permita facilitar su aplicación y contribuir a mejorar la calidad de la atención médica.
– Dirección de Ingeniería Biomédica su objetivo es, proponer instrumentos de gestión de equipo médico, para su uso apropiado, eficiente y seguro en el Sistema Nacional de Salud, a través de la generación e integración de información y la coordinación de esfuerzos sectoriales, que permitan la mejora de la calidad en la atención médica de la población.
– Dirección de Telesalud que tiene por objetivo coordinar la adecuada incorporación y uso de las aplicaciones de telemedicina, telediagnóstico, tecnologías móviles mediante la elaboración de políticas e instrumentos en materia de Telesalud, con el fin apoyar la mejora del acceso efectivo en el sector salud.
Para mayor información actualizada se puede acceder al Programa Anual de Trabajo del CENETEC 2022.
Recursos:
El CENETEC cuenta con un presupuesto propio, el cual es aprobado por la H. Cámara de Diputados en el Presupuesto de Egresos de la Federación y es asignado a través de la Secretaría de Hacienda y Crédito Público de manera anual.
Para mayor información: https://www.gob.mx/salud/cenetec, Secretaría de Hacienda y Crédito Público. Analíticos del Presupuesto de Egresos de la Federación https://www.pef.hacienda.gob.mx/es/PEF/Analiticos_PresupuestariosPEF
 Paraguay
Paraguay El Comité de Farmacoterapeútica está conformado por referentes de diferentes servicios del Ministerio de Salud, así como por representantes de la Facultad de Medicina y de la Facultad de Ciencias Químicas, de la Universidad Nacional de Asunción (UNA). Además del Comité Central, luego se definirán los regionales, para un trabajo estratégico en relación a la necesidad puntual de cada centro.
El comité no cuenta con un presupuesto asignado, depende de la Dirección General de Gestión de Insumos Estratégicos del Ministerio de salud.
 Perú
Perú Las funciones de la RENETSA son:
– Articular e integrar las actividades de los que conforman la RENETSA,
– Proponer documentos normativos para las evaluaciones de tecnologías sanitarias (ETS)
– Priorizar las solicitudes y realizar las ETS y las evaluaciones económicas, destinadas a proponer las mejores estrategias en la prevención, diagnóstico, tratamiento, rehabilitación y atención integral.
– Difundir los informes finales de ETS a través de un repositorio virtual de la RENETSA.
– Difundir las actividades de la RENETSA y fomentar la utilización de los informes de ETS para la toma de decisiones.
– Fomentar el desarrollo de capacidades de las instituciones del sistema de salud para la elaboración de ETS.
– Responder a las solicitudes de ETS de las Comisiones Consultivas Institucionales (CCI) conformadas en el Ministerio de Salud, Seguro Social de Salud, Gobiernos regionales, Sanidad de las Fuerzas Armadas y Sanidad de la Policía Nacional del Perú, para el caso de las tecnologías de alto costo para enfermedades raras o huérfanas.
– Atender las ETS que sean requeridas por la Autoridad Nacional de Salud,
– Modificar su reglamento interno.
La Unidad de Análisis y Generación de Evidencias en Salud Pública (UNAGESP) dependiente del Centro Nacional de Salud Pública del INS cumple sus funciones a través de la siguiente estructura orgánica:
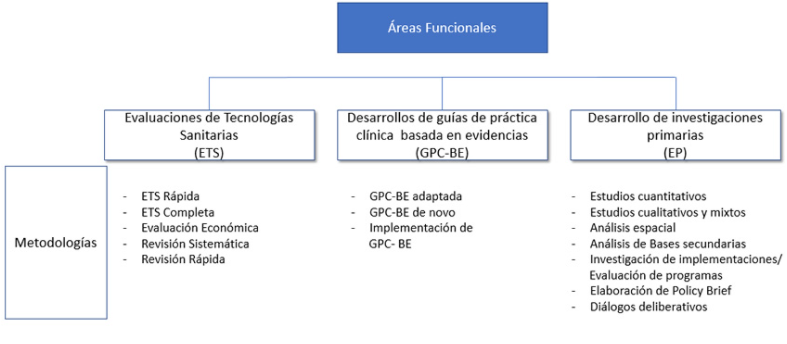
La Dirección General de Medicamentos, Insumos y Drogas (DIGEMID) dependiente del Despacho Viceministerial de Salud Pública se estructura de la siguiente forma:
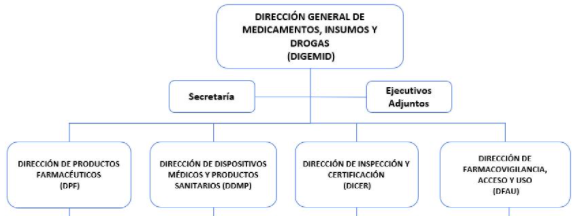
El Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) está constituido por unidades orgánicas creadas para lograr los objetivos institucionales:
La RENETSA no cuenta con un presupuesto propio asignado. El INS y el CNSP sí cuentan con presupuesto propio asignado.
 República Dominicana
República Dominicana A partir de agosto 2021, la SISALRIL cuenta con un departamento de Evaluación y Análisis Económicos, la cual tendrá dentro de sus funciones la Evaluación de Tecnologías Sanitarias, apoyado por la Dirección de Aseguramiento en Salud para los Regímenes Contributivo y Planes, en el componente médico.
 Uruguay
Uruguay La Agencia de Evaluación de Tecnologías Sanitarias del Uruguay está dirigida por un Gerente General designado por el Ministerio de Salud Pública. A su vez, el Gerente General designa un Gerente Técnico y un Gerente Administrativo, cargos ambos que lo ocupan profesionales universitarios con notoria competencia e idoneidad en la materia.
Los gerentes permanecerán en su cargo durante cinco años y su mandato podrá ser renovado por decisión de la autoridad competente para su designación.
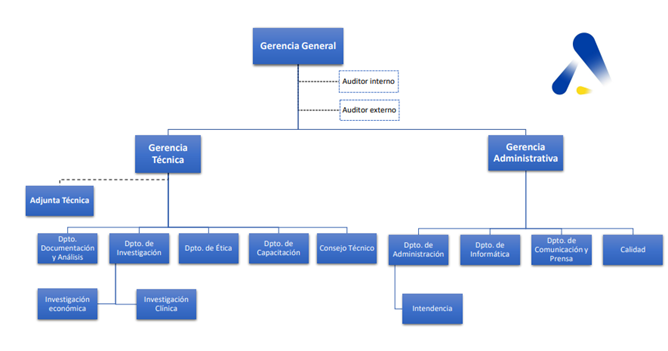
La estructura de la Gerencia Técnica está compuesta por los siguientes departamentos:
El Gerente Técnico tiene la potestad de proyectar la creación de nuevos departamentos, con la anuencia del Gerente General.
Presupuesto: Los recursos económicos de La Agencia provienen de aportes estatales (dotación propia asignada por la Ley N°19.924 de Presupuesto Nacional) y de recaudaciones propias a través de los servicios brindados (evaluaciones, protocolos de investigación, asesorías, cursos de capacitación, entre otros).
 Argentina
Argentina La CONETEC, cuenta con la asesoría técnica de instituciones académicas y científicas independientes con experiencia en la temática para integrar los Grupos de Trabajo:
– Red Argentina de Evaluación de Tecnologías Sanitarias (RedArETS)
– Universidad ISALUD (ISALUD)
– Instituto de Efectividad Clínica y Sanitaria (IECS)
– Centro Universitario de Farmacología de la Universidad Nacional de la Plata (CUFAR – UNLP)
– Instituto de Medicina para la Seguridad Social y Evaluación Tecnológica (IMSSET – UBA).
La CONETEC, es miembro de RedETSA, junto con otras organizaciones del país como son el CUFAR, el IECS, y la RedArETS.
 Brasil
Brasil La Comisión Nacional para la Incorporación de Tecnologías en el Sistema Único de Salud (Conitec) está vinculada a varias agencias y organismos internacionales involucrados en acciones para mejorar y difundir la Evaluación de Tecnologías Sanitarias (ETS) en Brasil y en el mundo. Conitec apoya y es miembro de las siguientes iniciativas:
– RedETSA (Red de Evaluación de Tecnologías en Salud de las Américas).
– EUROSCAN (EuroScan international network e.V.).
– GIN (Guidelines International Network).
– HTAi (Health Technology Assessment International).
– INAHTA (International Network of Agencies for Health Technology Assessment).
– REBRATS (Rede Brasileira de Avaliação de Tecnologias em Saúde).
Más miembros de RedETSA de Brasil:
– Agência Nacional de Vigilância Sanitária (ANVISA)
– Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde (CONITEC)
– Núcleo de Avaliação de Tecnologias em Saúde – Instituto Sírio – Libanês de Ensino e Pesquisa, Hospital Sírio Libanês
– El Centro Colaborador do SUS para Avaliação de Tecnologias e Excelência em Saúde (CCATES)/ Universidade Federal de Minas Gerais (UFMG)
– Instituto de Engenharia Biomédica/Universidade Federal de Santa Catarina (IEB/UFSC)
– Instituto Nacional de Cardiologia (INC)
– Agencia Nacional de Saude Suplementar (ANS)
 Chile
Chile El Ministerio de Salud de Chile, mediante licitaciones encarga a otros organismos independientes, tales como universidades y consultoras, la elaboración de estudios e informes relacionados al área ETS.
El Ministerio de Salud de Chile y el Instituto de Salud Pública de Chile son miembros de RedETSA. Junto con el Instituto de Salud Pública (ISP) de Chile también forma parte de ORAS CONHU en diversos comités, entre ellos el de Evaluación de Tecnologías Sanitarias. A través del Departamento de ETESA/SBE, se participa además en las actividades de la HTAi.
 Costa Rica
Costa Rica Tanto la Dirección de Desarrollo Científico y Tecnológico en Salud del Ministerio de Salud de Costa Rica, como la Caja Costarricense de Seguro Social son miembros de RedETSA.
 Ecuador
Ecuador En Ecuador, el desarrollo de ETS están bajo las atribuciones y responsabilidades de la Dirección Nacional de Inteligencia de la Salud del Ministerio de Salud Pública y de forma general no se suele encargar a otros organismos independientes la elaboración de informes de ETS. No obstante, existen otros pocos actores de índole privado que dedican su esfuerzo a la generación de informes de eficacia, seguridad y estudios económicos, principalmente solicitados por la industria farmacéutica.
La Dirección Nacional de Inteligencia de la Salud es miembro de la Red de Evaluación de Tecnologías Sanitarias de las Américas – RedETSA.
 El Salvador
El Salvador El Ministerio de salud no encarga a otros organismos independientes la preparación de informes de ETS ya que son elaborados por la UETS.
La Unidad de Evaluación de Tecnologías Sanitarias del Ministerio de salud de El Salvador, es miembro de RedETSA junto con otros organismos del país: El Instituto Salvadoreño del Seguro Social (ISSS) y la Dirección Nacional de Medicamentos (DNM).
 Guatemala
Guatemala El Ministerio de Salud Pública y Asistencia Social no encarga a otros organismos independientes la preparación de informes de ETS.
La Dirección Terapéutica Central del IGSS, es miembro de RedETSA desde 2022.
 México
México El Centro Nacional de Excelencia Tecnológica en salud – CENETEC, es Centro Colaborador OMS/OPS desde 2009 y es miembro de la Red de Evaluación de Tecnologías en Salud de las Américas (RedETSA) desde su creación en 2011.
A nivel nacional en diciembre de 2012, se instituyó el Grupo de Trabajo Interinstitucional de Evaluación de Tecnologías para la Salud (GTI-ETES) cuyo objetivo fundamental es “Promover entre las Instituciones Públicas del Sistema Nacional de Salud, la Evaluación de Tecnologías para la Salud como una herramienta generadora de información, orientada al apoyo en la toma de decisiones relacionadas con la incorporación, uso o retiro de tecnologías, para contribuir al acceso y a la calidad de los servicios de salud así como al uso óptimo de los recursos”.
El GTI-ETES es Presidido por el Titular del Centro Nacional de Excelencia Tecnológica en Salud y está conformado por un representante y un suplente de las siguientes instituciones:
– Secretaría de Salud: Instituto de Salud para el Bienestar (INSABI), Comisión Coordinadora de Institutos Nacionales de Salud y Hospitales de Alta Especialidad, Dirección General de Políticas de Investigación en Salud y la Unidad de Análisis Económico;
– Instituto Mexicano del Seguro Social (IMSS): Dirección de Prestaciones Médicas y Dirección de Finanzas
– Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE): Dirección Normativa de Salud y Dirección Normativa de Prospectiva y Planeación Institucional
– Dirección General de Sanidad de la Secretaría de la Defensa Nacional (SEDENA);
– Dirección General Adjunta de Sanidad Naval de la Secretaría de Marina, Armada de México (SEMAR);
– Subdirección de Servicios de Salud de Petróleos Mexicanos (PEMEX).
 Paraguay
Paraguay El Ministerio de Salud y Bienestar Social de Paraguay es miembro de RedETSA.
El país solicita la elaboración de ETS a otros organismos.
 Perú
Perú Tanto el Ministerio de Salud a través de DIGEMID, como el Instituto Nacional de Salud y el Instituto de Evaluación de Tecnologías de Salud del Seguro Social Nacional son miembros activos de RedETSA. Recientemente, también la Unidad Funcional de Evaluación de Tecnología Sanitaria del Instituto Nacional de Enfermedades Neoplásicas (UFETS-INEN) se incorporó a RedETSA.
El IETSI es además es miembro activo de INAHTA desde el año 2019.
 República Dominicana
República Dominicana La Superintendencia de Salud y Riesgos Laborales (SISALRIL) es miembro de RedETSA.
Hasta el momento, el país no ha solicitado a otros organismos la elaboración de ETS. En algunos casos para el proceso de elaboración de propuestas puede consultarse ETS de otro país para tecnologías similares.
 Uruguay
Uruguay El país cuenta con cuatro miembros en la RedETSA:
– la Unidad Especializada de Evaluación de Tecnologías Sanitarias, del Ministerio de Salud Pública de Uruguay;
– el Fondo Nacional de Recursos (FNR);
– la Unidad Académica de Evaluación de Tecnologías del Departamento de Medicina Preventiva y Social, Facultad de Medicina, de la Universidad de la República;
– y la Agencia de ETS de Uruguay, AETSU.
La AETSU cuenta con la asesoría técnica de instituciones académicas, sociedades científicas y expertos independientes para a aquellos casos que amerite. Está vinculada a diferentes organismos nacionales (Ministerio de Salud Pública, FNR, Academia) e internacionales involucrados en acciones para mejorar y difundir la ETS, y trabaja en colaboración con NICE (National Institute for Health and Care Excellence) y SECS (Servicio Canario de la Salud).
 Argentina
Argentina Directrices:
El país cuenta con sus propias directrices o guías nacionales para la elaboración de los informes de ETS. Se pueden encontrar en:https://www.argentina.gob.ar/salud/conetec/documentos-tecnicos
No cuentan con guías nacionales para la adaptación de informes de ETS de otros países y no se realizan adaptaciones regularmente.
Aspectos abarcados en las ETS elaboradas:
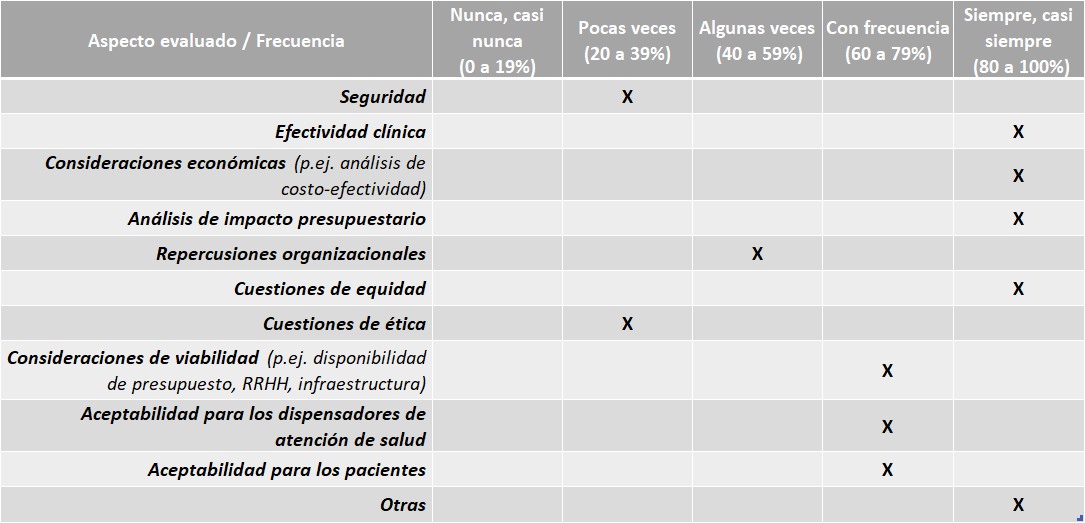
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2021. Actualizado por parte del país en 2024.
 Brasil
Brasil Directrices:
El país cuenta con sus propias directrices o guías nacionales para la elaboración de los informes de ETS, de revisiones sistemáticas y de evaluaciones económicas. Se pueden encontrar en: http://conitec.gov.br/biblioteca-virtual
El país cuenta con un Manual metodológico para la Identificación y Evaluación de Tecnologías Nuevas y Emergentes en Salud.
No cuentan con guías nacionales para la adaptación de informes de ETS de otros países.
Aspectos evaluados en los informes de ETS:
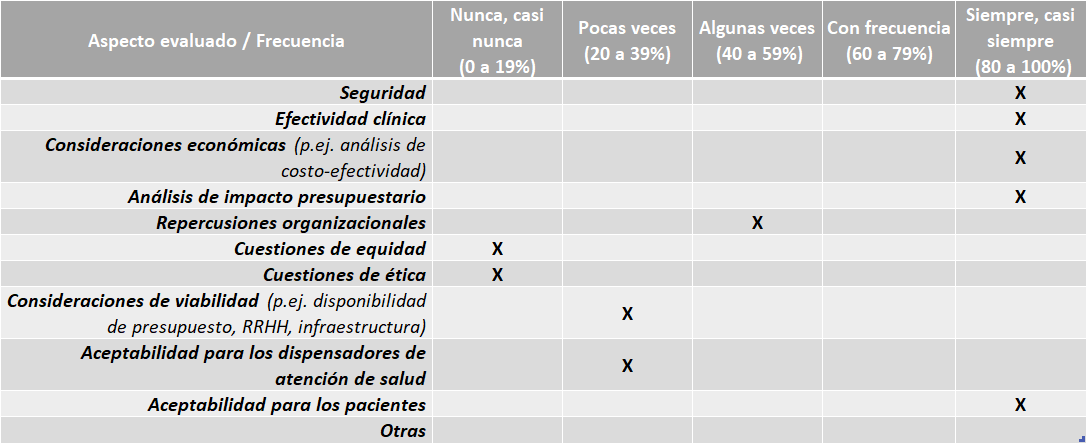
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2021.
 Chile
Chile Directrices:
El país cuenta con sus propias directrices o guías nacionales para la elaboración de los informes de ETS y de evaluaciones económicas:
Además, se encuentran en proceso de elaboración y publicación, diversas guías metodológicas, entre ellas la Guía Metodológica de Impacto Presupuestario de Intervenciones en Salud de Chile y de adaptación de informes de ETS de otros países.
Aspectos abordados en las ETS elaboradas:
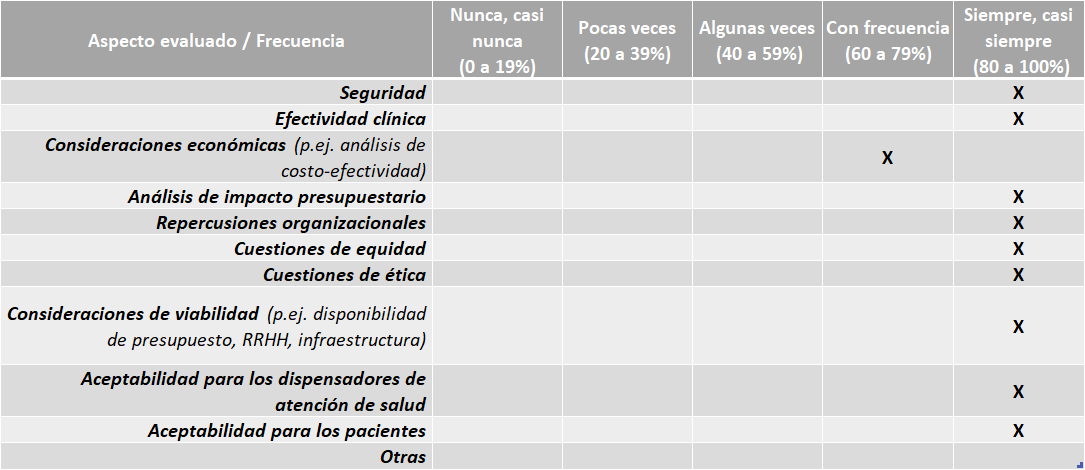
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2021.
 Costa Rica
Costa Rica Directrices:
El país no cuenta con sus propias directrices o guías nacionales para la elaboración de los informes de ETS o para la elaboración de evaluaciones económicas. Tampoco cuenta con guías para la adaptación de informes de ETS de otros países.
Aspectos abordados en las ETS elaboradas por la Caja Costarricense de Seguro Social:
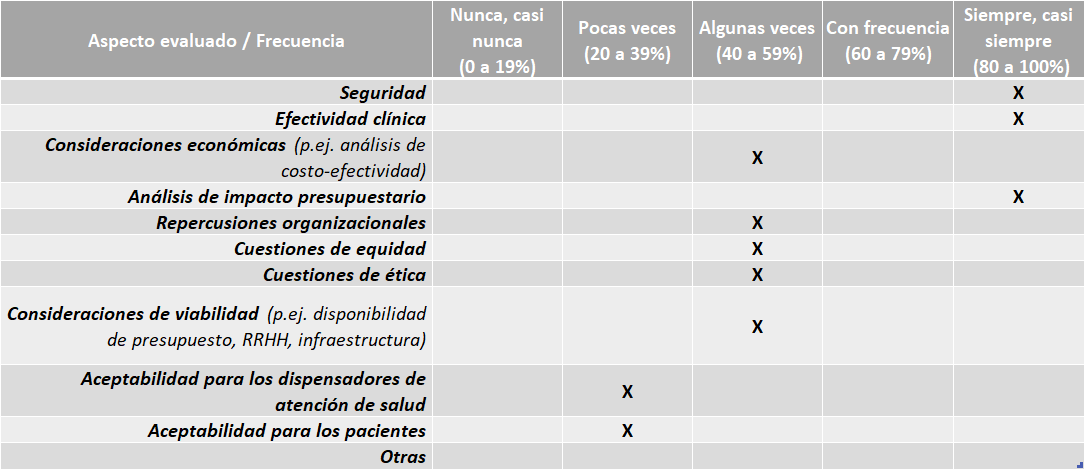
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2021.
 Ecuador
Ecuador Al momento los informes técnicos que se generan a nivel del Ministerio de Salud se fundamentan en guías y/o manuales metodológicos desarrollados por diferentes agencias o instituciones de evaluación de tecnologías sanitarias como la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud, el Instituto de Evaluación Tecnológica en Salud de Colombia, la Comisión Nacional de Evaluación de Tecnologías Sanitarias de Argentina y según recomendaciones de otros autores independientes como Mauskopf et al., 2017, Foroutan et al., 2018 y Drummond et al., 1998.
Cabe mencionar que actualmente el país se encuentra desarrollando sus propios manuales metodológico para la elaboración de informes rápidos de ETS, análisis de impacto presupuestario de tecnologías de salud y evaluaciones económicas mismas que tienen previstos emitirse en el primer trimestre del 2022.
Aspectos evaluados en los informes de ETS:
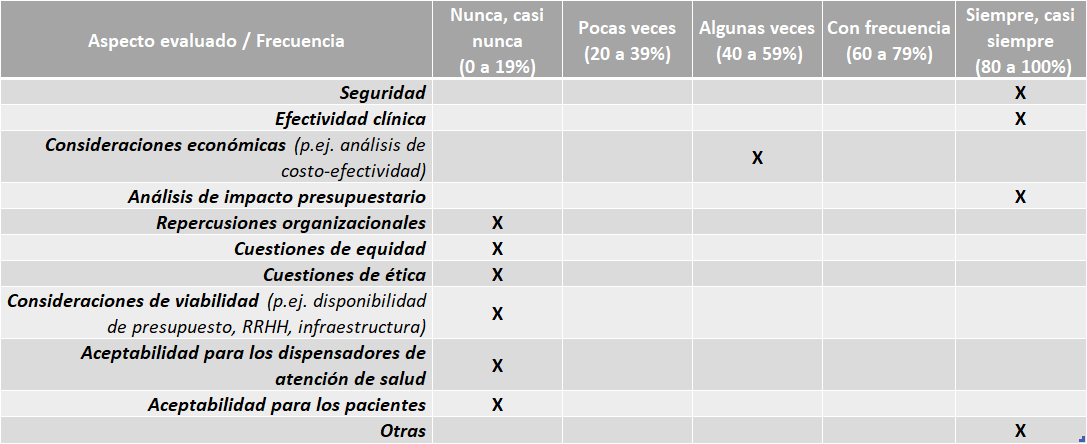
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2021.
 El Salvador
El Salvador Directrices:
El país no cuenta con directrices o guías nacionales propias para la elaboración de los informes de ETS o evaluaciones económicas.
Al momento, el país se encuentra en proceso de validación del documento para la elaboración de protocolo de ETS, como el de informe de ETS, los cuales servirán para el ISSS como para el MINSAL.
Aspectos abordados en las ETS elaboradas:
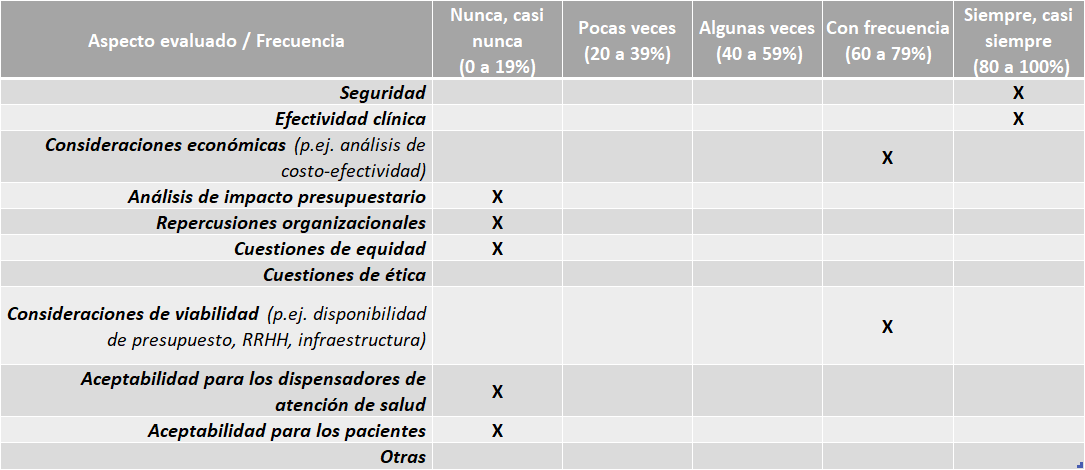
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2021.
 Guatemala
Guatemala Directrices:
El país no cuenta con directrices o guías nacionales propias para la elaboración de los informes de ETS o evaluaciones económicas.
La Dirección Terapéutica Central del IGSS cuenta con un Manual de Normas y Procedimientos de Evaluación de Tecnologías Sanitarias para Medicamentos.
Aspectos abordados en las ETS elaboradas por IGSS:
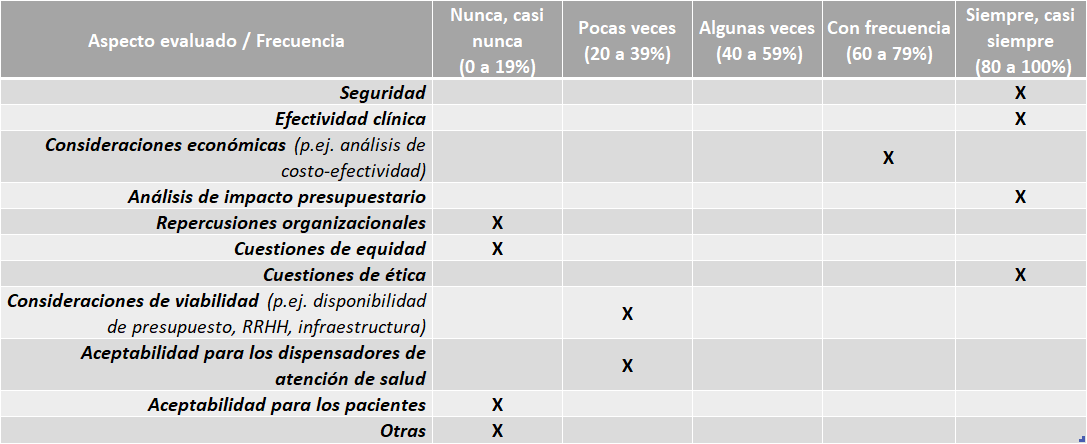
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2022.
 México
México Directrices:
El país cuenta con sus propias directrices o guías nacionales para la elaboración de los informes de ETS, los documentos desarrollados por el CENETEC para este fin son:
– Documento metodológico – Evaluación de Tecnologías para la Salud, 2010.
– Guía para la Evaluación Clínica de Dispositivos Médicos, 2017
– Guía para la Evaluación económica de Dispositivos Médicos, 2017.
Disponibles en: https://www.gob.mx/salud/cenetec/acciones-y-programas/conceptos-basicos-de-evaluacion-de-tecnologias-para-la-salud
También se cuenta con documentos emitidos por el Consejo de Salubridad General que hacen referencia al proceso de Evaluación de Tecnologías, y son de apoyo a los procesos de deliberación que se llevan a cabo a través de los Comités Técnicos Específicos de la Comisión Interinstitucional del Cuadro Básico y Catálogo de Insumos del Sector Salud (CICBCISS), que son:
– Guía para la Conducción de Estudios de evaluación económica para la actualización del cuadro básico y catálogo de insumos del sector salud en México, 2017.
– Guía de Evaluación de Insumos para la Salud, 2017.
Disponibles en: http://www.csg.gob.mx/contenidos/priorizacion/cuadro-basico/guias/guias.html
No se cuenta con guías nacionales para la adaptación de informes de ETS de otros países y no se realizan adaptaciones regularmente.
Aspectos abarcados en las ETS elaboradas:
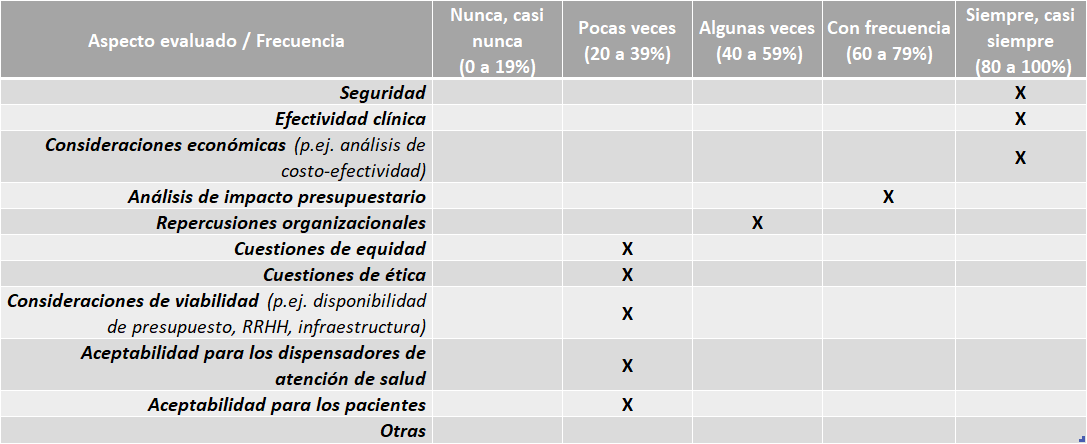
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2021.
 Paraguay
Paraguay Directrices:
El país no cuenta con sus propias directrices o guías nacionales para la elaboración de los informes de ETS o para el desarrollo de evaluaciones económicas.
Tampoco se cuentan con guías nacionales para la adaptación de informes de ETS de otros países.
Aspectos evaluados en los informes de ETS – Selección de Medicamentos:
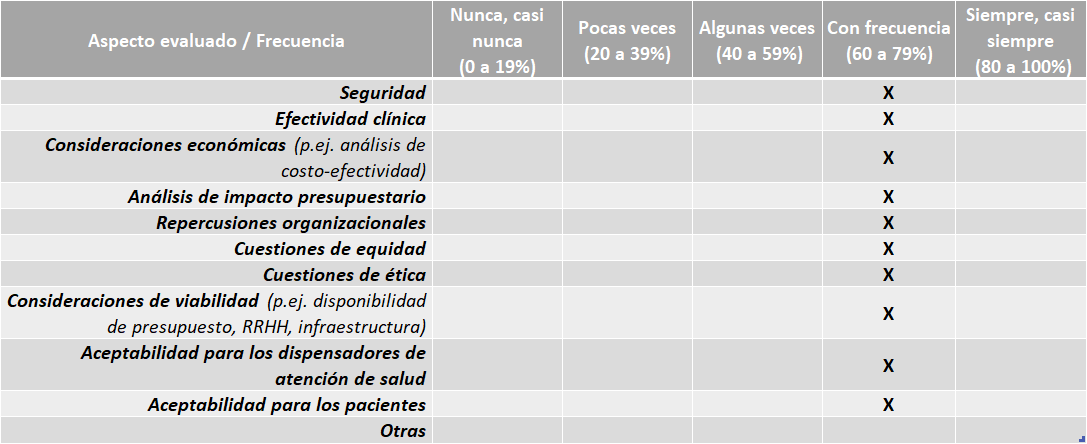
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2021.
 Perú
Perú La RENETSA, la UNAGESP y la DIGEMID no cuentan con Directrices no cuentan con directrices propias o guías nacionales para la elaboración de los informes de ETS.
El IETSI cuenta con un “Manual para la elaboración de evaluación de tecnologías sanitarias de productos farmacéuticos: dictámenes preliminares de eficacia y seguridad”, el que se oficializo en el año 2018 para uso obligatorio de la DETS-IETSI mediante el Memorando N° 001-DETS-IETSI-2018.
La UFETS – INEN, cuenta con un Manual de Procesos y Procedimientos (MAPRO) que tiene como finalidad describir y establecer formalmente los procesos y procedimientos que coadyuven al cumplimiento de los objetivos y acciones estratégicos relacionadas a la gestión de la evaluación de tecnologías sanitarias en el Instituto Nacional de Enfermedades Neoplásicas – INEN.
Los organismos no cuentan con directrices para la elaboración de evaluaciones económicas ni para la adaptación de informes de ETS de otros países.
Aspectos abarcados en las ETS elaboradas (según INS – CNSP):
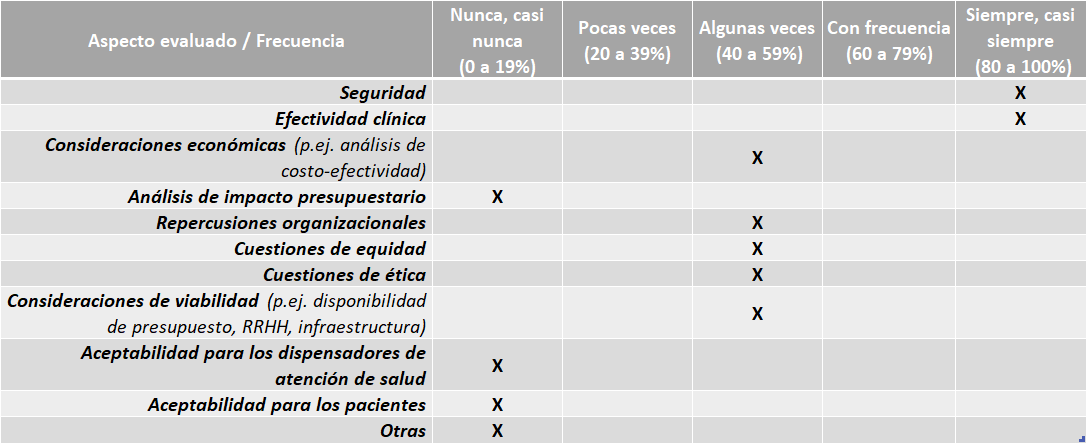
Fuente: Resultados de la Encuesta de Enfoque Integrado. OPS, 2019-2021.
 República Dominicana
República Dominicana Directrices:
El país no cuenta con sus propias directrices o guías nacionales para la elaboración de los informes de ETS o para el desarrollo de evaluaciones económicas.
Tampoco se cuentan con guías nacionales para la adaptación de informes de ETS de otros países.
Aspectos evaluados en los informes de ETS – Selección de Medicamentos:
Se evalúa seguridad y efectividad clínica.
 Uruguay
Uruguay AETSU aplica directrices propias para la elaboración de informes de Tecnologías Sanitarias, revisiones sistemáticas, evaluaciones económicas y síntesis rápida de evidencia. Los procesos y documentos asociados se mantienen en sus últimas versiones en una plataforma cloud del sistema de gestión de calidad.
A nivel de regional se ha trabajado por parte de la Universidad de la República, y de otros miembros de RedETSA, en la elaboración de una Herramienta para la adaptación de informes de ETS provenientes de otros países.
Aspectos evaluados en los informes de ETS:
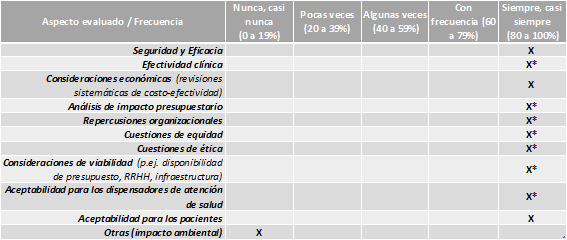
Fuente: AETSU, datos correspondientes a 2023.
 Argentina
Argentina Aspectos operativos del proceso de ETS:
En primer término, anualmente la CONETEC mediante un mecanismo abierto y participativo recibe las propuestas de TS a evaluar a través de un llamado público en la página web. En segundo lugar, se discuten las propuestas recibidas y se confecciona el listado de las TS priorizadas según la Herramienta de Priorización y al final del proceso se elabora un cronograma para los siguientes meses. El listado final de TS a evaluar es decidido por la Mesa de Priorización.
Para comenzar el proceso de ETS de una TS, la CONETEC debe definir: el enfoque de la evaluación definiendo población, compradores y desenlaces; los actores de interés a ser convocados; los responsables de la elaboración y redacción del informe de ETS y el cronograma de trabajo. Luego de un periodo de aproximadamente cuatro meses de trabajo por parte de los grupos de trabajo, los hallazgos se presentan a la Mesa Técnica y luego a la mesa de Recomendaciones. Finalmente, el documento se publica en versión preliminar por diez días hábiles para consulta pública, donde después de ver los comentarios se publica la versión definitiva.
Transparencia:
Cuenta con declaración de conflicto de intereses. En el siguiente enlace se puede descargar el Acuerdo de reserva y uso confidencial de la información y el Formulario de declaración de conflictos de interés potencial: https://www.argentina.gob.ar/salud/conetec/funcionamiento
 Brasil
Brasil Aspectos operativos del proceso de ETS:
En primer lugar, la ley establece el requisito de registro previo y aprobación del producto ante la Agencia Nacional de Vigilancia Sanitaria – Anvisa para que pueda ser evaluado para su incorporación al SUS.
Como se dijo anteriormente, además del registro, en el caso de los medicamentos, también es necesario contar con el precio máximo de venta aprobado por la Cámara de Regulación del Mercado de Medicamentos – CMED.
El solicitante envía los documentos requeridos, que se analizan primero si se enviaron de acuerdo con la legislación (análisis de conformidad).
Con la conformidad documental debidamente atestiguada, los estudios enviados por el solicitante se someten a un análisis crítico o, si el solicitante es interno (secretarías del Ministerio de Salud), se preparan nuevos estudios de ETS y se envía un informe para consideración preliminar por el Plenario y luego se somete a consulta pública. Todos los aportes recibidos en la consulta pública son analizados y presentados al Plenario, que emite su recomendación final.
El sitio web de CONITEC tiene un apartado para presentar las demandas de tecnologías ya evaluadas o en evaluación: http://conitec.gov.br/tecnologias-em-avaliacao
En el proceso de evaluación de una tecnología de salud se tienen en cuenta si la misma está considerada ya o no en las GPC.
Los informes completos de ETS son realizados internamente (técnicos del equipo de la Conitec) o por la contratación de NATS.
Transparencia: La Conitec cuenta con declaración de conflicto de intereses con estándares y procedimientos definidos para la presentación y valoración de las mismas por parte de los participantes de la elaboración de informes de ETS.
 Chile
Chile Aspectos operativos del proceso de ETS:
Actualmente, existe un proceso ETS establecido para los tratamientos de alto costo que son evaluados bajo el amparo de la Ley N° 20.850 conocida como Ley Ricarte Soto (LRS), la cual crea un sistema de protección financiera para dar cobertura a este tipo de tecnologías sanitarias. Todos los aspectos metodológicos y de operación se encuentran establecidos en la Ley, su reglamento y norma técnica. Estos documentos se encuentran publicados y son de acceso libre: https://leyricartesoto.minsal.cl/#/articulos/proceso-de-evaluacion-de-garantias
Además, se realizan otros procesos de ETS para otros sistemas de cobertura, tales como Drogas de Alto Costo en Cáncer y para la ley de Garantías Explícitas en Salud (GES), los cuales no están formalizados bajo una ley o reglamento, pero el Departamento trabaja para homogeneizar estos procesos de ETS a lo establecido en la LRS.
Asimismo, se cuenta con un servicio de respuesta rápida, donde se responden las necesidades de ETS de la comunidad del Ministerio de Salud de Chile.
Transparencia: Para dar garantía de transparencia durante el desarrollo de los procesos ETS se solicita declaración de conflicto de intereses y compromiso de confidencialidad a todos los participantes del proceso de evaluación. Existen estándares y procedimientos definidos para la presentación y valoración de la declaración de los conflictos de interés por parte del equipo de trabajo.
 Costa Rica
Costa Rica Aspectos operativos del proceso de ETS:
El Comité Central de Farmacoterapia, siempre fundamenta la toma decisiones respecto a la incorporación de un nuevo medicamento en la Lista Oficial de Medicamentos «LOM» (o apoyo en ciertas situaciones clínicas, como medicamento no LOM) en un informe técnico. En general, el Área de Medicamentos y Terapéutica Clínica de la CCSS prepara un informe técnico con la revisión crítica de la literatura disponible sobre eficacia y seguridad del medicamento y si se documenta que puede cubrir una necesidad institucional, se solicita al Área de Fármaco-economía un informe económico, como mínimo un estudio de costos, en general se hacen análisis de impacto presupuestario y adaptaciones de estudios de costo efectividad.
El Ministerio de Salud no encarga la elaboración de informes de ETS a organismos independientes.
Transparencia:
Los miembros del Comité Central de Farmacoterapia y los funcionarios de la Dirección de Farmacoepidemiología suscriben un documento de declaración de no conflictos de interés. El reglamento del Comité Central de Farmacoterapia establece las incompatibilidades para ser miembro del mismo. En el formulario para solicitud de tratamiento crónico con un medicamento no incluido en la Lista Oficial de Medicamentos, el médico que solicita, debe llenar un apartado con la declaratoria de conflictos de interés.
 Ecuador
Ecuador Aspectos operativos del proceso de ETS:
Marco legal:
El “Reglamento sustitutivo para autorizar la adquisición de medicamentos que no constan en el Cuadro Nacional de Medicamentos Básicos – CNMB vigente” establece que, los establecimientos de salud de Tercer Nivel de Atención de la Red Pública Integral de Salud (RPIS) que requieran un medicamento que no conste en el CNMB vigente, en los casos de enfermedades cuyo pronóstico de vida tengan un desenlace inevitablemente fatal, enfermedades raras y otras de baja prevalencia, deberán cumplir con el siguiente procedimiento:
Solicitud: El médico prescriptor, quién considera pertinente iniciar el tratamiento con uno o más medicamentos que no formen parte del Cuadro Nacional de Medicamentos Básicos para un paciente determinado, debe remitir una solicitud debidamente justificada al Comité de Farmacoterapia del establecimiento de salud, quien a su vez evalúa la pertinencia de la solicitud y de ser el caso eleva, a través de la máxima autoridad de cada institución de la Red Pública Integral de Salud (RPIS), el requerimiento a la Máxima Autoridad Sanitaria en Salud. El ingreso de solicitudes se realiza de manera trimestral, en los meses de enero, abril, julio y octubre.
Procedimiento Interno: El Ministerio de Salud a través de la Dirección Nacional de Medicamentos y Dispositivos Médicos verifica que la información ingresada se encuentre completa y en caso afirmativo remite el expediente a la Coordinación General de Desarrollo Estratégico en Salud para su análisis técnico a través de sus Direcciones Nacionales: Dirección Nacional de Inteligencia de la Salud y Dirección Nacional de Economía de Salud.
Evaluación: Los informes de análisis de eficacia y seguridad son desarrollados por la Dirección Nacional de Inteligencia de la Salud; para aquellos medicamentos que demuestren tener un valor terapéutico añadido (incremental, es decir, respecto la mejor alternativa disponible), se considera pertinente realizar una evaluación económica a través de la Dirección Nacional de Economía de Salud. Ambos insumos técnicos son emitidos en un plazo máximo de treinta (30) días de forma secuencial.
– Talento Humano: A nivel operativo la Coordinación General de Desarrollo Estratégico en Salud cuenta con 4 personas capacitadas que desarrollan los informes de ETS y otros insumos técnicos.
– Transparencia: Si bien los informes no están disponibles para el público en general estos son remitidos a los diferentes actores que forman parte del proceso de deliberación y decisión. Cabe mencionar que, bajo lo dispuesto en el segundo numeral del artículo 18 de la Constitución de la República del Ecuador 2008 es derecho de todas las personas el acceso a la información generada en instituciones públicas, o privadas que manejen fondos públicos o realicen funciones públicas, por lo tanto los informes de ETS pueden ser solicitados por la ciudadanía en cualquier momento. El Ministerio de Salud cuenta con una declaración de conflicto de intereses con valoración de la declaración de conflicto de interés por parte del equipo participante de la elaboración de los informes de ETS.
Decisión: El Comité para Autorizar o No Autorizar la Adquisición de Medicamentos que no Constan en el CNMB vigente (CAAME) en sesión ordinaria o extraordinaria analiza los insumos técnicos y los pronunciamientos de los diferentes actores, en base a los cuales deliberan y emiten su decisión para autorizar o no la adquisición de un medicamento que no forma parte del CNMB.
Seguimiento: Una vez autorizada la adquisición de un medicamento que no conste en el CNMB vigente, el solicitante debe presentar de manera periódica al Ministerio de Salud la Ficha de Seguimiento de Uso del Medicamento.
Apelación: En el caso de existir apelaciones, éstas serán consideradas, por una única vez, en el siguiente período de recepción de solicitudes, siempre que se sustente con nuevos avances de evidencia científica disponible y de buena calidad metodológica, que permitan determinar que el uso del medicamento demuestra superioridad terapéutica en desenlaces de relevancia clínica.
El procedimiento expuesto es de aplicación obligatoria para todas las instituciones que conforman la RPIS y para la Red Privada Complementaria (RPC), en el marco de la prestación de servicios de salud a pacientes derivados desde la RPIS.
A través de la página web del Ministerio de Salud Pública se pública periódicamente el listado de medicamentos Autorizados por fuera del CNMB (https://www.salud.gob.ec/medicamentos-autorizados-por-fuera-del-cnmb/)
 El Salvador
El Salvador Aspectos operativos del proceso de ETS:
Al momento no se cuenta aún con un proceso oficial de recolección de evidencia científica a nivel nacional para la elaboración de los informes de ETS, evaluaciones de efectividad y/o económicas, etc.-
En la actualidad se desarrolla ETS solamente evaluando eficacia y seguridad de medicamentos, no se han desarrollado evaluaciones económicas, aunque se proyecta iniciar a mediano plazo con ellas.
Transparencia:
Cuenta con declaración de conflicto de intereses y existen estándares y procedimientos definidos para la presentación y valoración de los conflictos de interés por parte del equipo participante de la elaboración de los informes de ETS.
Las conclusiones de los informes de ETS no siempre son públicas y de fácil acceso para la sociedad civil. Los protocolos elaborados para los cuales se han realizado consultas públicas se encuentran disponibles: https://www.salud.gob.sv/documentos-para-consulta-publica-ets-dirtecs/
 Guatemala
Guatemala Aspectos operativos del proceso de ETS:
Al momento no se cuenta aún con un proceso oficial de recolección de evidencia científica a nivel nacional para la elaboración de los informes de ETS, evaluaciones de efectividad y/o económicas.
Si desde la Dirección de Terapéutica del IGSS se están elaborando informes de ETS para medicamentos e informes de ETS abreviados para medicamentos con el fin de incluir, modificar o excluir medicamentos a su Listado Básico de Medicamentos (LBM). En primer lugar se reciben los pedidos de los comités terapéuticos locales, que elevan la información al comité terapéutico central. Este evalúa la realización de un informe de ETS completo si el medicamento es de reciente aprobación por la agencia reguladora o un informe abreviado por ejemplo en caso de medicamentos ya incluidos en el LBM para ampliar su uso por ejemplo. Para realizarse la ETS debe cumplir ciertos requisitos que se establecen en el Manual de Normas y Procedimientos de Evaluación de Tecnologías Sanitarias para Medicamentos, disponible en: https://www.igssgt.org/wp-content/uploads/2021/12/6-resolucion-950-SPS-2021-Subgerencia-prestaciones-salud-IGSS.pdf
Transparencia:
La Dirección de Terapéutica Central del IGSS cuenta con declaración de conflicto de intereses y existen estándares y procedimientos definidos para la presentación y valoración de los conflictos de interés por parte del equipo participante de la elaboración de los informes de ETS.
Las conclusiones de los informes de ETS del IGSS son públicas y de fácil acceso para la sociedad civil una vez que el proceso de elaboración se encuentra finalizado.
 México
México Aspectos operativos del proceso de ETS:
A nivel administrativo se cuenta con un proceso de Evaluación de Tecnologías para la Salud definido en el Manual de Procedimientos del CENETEC; además, se desarrolló un Documento Metodológico con enfoque general y dos Guías metodológicas enfocadas en Dispositivos Médicos:
El Documento Metodológico de Evaluación de Tecnologías para la Salud en el que se describe con detalle el proceso de evaluación de tecnologías para la salud y algunos de los métodos empleados con mayor frecuencia, tiene el fin de colaborar en la armonización de la evaluación de tecnologías en las instituciones públicas del Sistema Nacional de Salud en México.
Las Guías para la Evaluación Clínica y Evaluación económica de Dispositivos Médicos tienen como objetivo describir en cada uno de sus ámbitos, las directrices para la realización de evaluaciones de tecnologías para la salud de calidad metodológica adaptada a las características de los dispositivos médicos, cumpliendo con los requerimientos que exige el marco normativo establecido en materia de salud para México.
Estos documentos son complementarios al proceso definido por el Consejo de Salubridad General (CSG) en la Guía de Evaluación de Insumos para la Salud y en la Guía para la Conducción de Estudios de Evaluación Económica para la Actualización del Cuadro Básico y Catálogo de Insumos del Sector Salud.
El proceso de actualización del Compendio Nacional de Insumos para la Salud (CNIS) se enmarca en el Reglamento Interior de la Comisión Interinstitucional del Cuadro Básico y Catálogo de Insumos del Sector Salud. En este se fundamenta la entrega de información a la Comisión por los solicitantes y su revisión por los Comités Técnicos Específicos. La información que se solicita incluye aspectos clínicos, de seguridad y aspectos económicos relacionados con el insumo. Cuando se determina que una solicitud cumple con los requisitos establecidos en el reglamento citado, se informa a los solicitantes y se envía al Comité correspondiente para su evaluación. Los miembros de los Comités y en su caso los expertos realizarán una evaluación crítica de la evidencia clínica y económica que acompaña las solicitudes con la finalidad de fundamentar su opinión institucional.
Por reglamento, la emisión del dictamen desde la aceptación de una solicitud no debe pasar un periodo de 90 días hábiles, en el cual los integrantes del Comité deben realizar el análisis y la evaluación del insumo. En la etapa de la evaluación debe considerar una revisión crítica de la información entregada en la solicitud, así como de la búsqueda de información adicional que ayude a tomar la decisión.
CENETEC deberá emitir su opinión técnica por escrito, de las solicitudes remitidas, en un plazo no mayor a 40 días hábiles.
Los documentos que genera el CENETEC a través del Grupo de Trabajo Interinstitucional de Evaluación de Tecnologías (GTI-ETES) y que responde a las necesidades del Sistema Nacional de Salud, tienen un periodo de elaboración de 6 a 12 meses.
Transparencia:
Toda la información que genera el CENETEC debe cumplir lo estipulado en la Ley Federal de Transparencia y Acceso a la Información Pública y en la Ley General de Transparencia y Acceso a la información Pública. Actualmente los informes que elabora el CENETEC relacionados a la actualización del CNIS solicitados a través del CSG deben cumplir con los criterios de confidencialidad descritos en el Reglamento Interior de la Comisión Interinstitucional del Cuadro Básico y Catálogo de Insumos del Sector Salud. Para dar garantía de transparencia durante el desarrollo de los procesos Evaluación de Tecnologías, se solicita la firma de una carta de declaración de conflicto de intereses y de confidencialidad de la información a todos los participantes del proceso de evaluación.
De acuerdo al artículo 54 del Reglamento de la Comisión, con el propósito de asegurar la confidencialidad de la información documental, los expertos, los miembros de los Comités, los invitados y los funcionarios y empleados al servicio de las dependencias gubernamentales que tengan acceso a ella deberán firmar una carta de confidencialidad y abstenerse de revelar la información en términos de las disposiciones legales y reglamentarias vigentes.
Los solicitantes de actualización de insumos que sean aceptados para evaluación podrán consultar el avance en el proceso de revisión en la página electrónica del CSG. Disponible en: http://www.csg.gob.mx/contenidos/priorizacion/cuadro-basico.html
Las evaluaciones de tecnologías que realiza CENETEC en respuesta a las peticiones de instituciones de salud, están a disposición en su página web: https://www.gob.mx/salud/cenetec/acciones-y-programas/conceptos-basicos-de-evaluacion-de-tecnologias-para-la-salud.
 Paraguay
Paraguay Aspectos operativos del proceso de ETS:
En el proceso de ETS se tienen en cuenta si la Tecnología de Salud está considerada en las GPC.
Transparencia: Cuentan con declaración de conflictos de interés por parte del equipo participante en las ETS. Los informes de ETS son públicos y se encuentran fácilmente accesibles.
El país encarga informes de ETS a otras instituciones/organismos.
 Perú
Perú Aspectos operativos del proceso de ETS:
Transparencia:
Cuentan con declaración de conflicto de intereses con estándares y procedimientos definidos para la presentación y valoración de los mismos por parte de los participantes de la elaboración de informes de ETS.
 República Dominicana
República Dominicana Aspectos operativos del proceso de ETS:
El país no encarga informes de ETS a otras instituciones/organismos. Actualmente para inclusiones de CBME, no se realizan ETS, en algunos casos solo se consulta documentos para incluir de soporte en las propuestas elaboradas; aunque pueden ser revisadas las realizadas por otros países.
 Uruguay
Uruguay Aspectos operativos del proceso de ETS:
La AETSU ha establecido procesos estratégicos, operativos y de apoyo para llevar a cabo sus actividades y alcanzar sus objetivos. En el área estratégica, se realizan procesos como la revisión por la dirección, auditorías internas y externas, e instancias grupales como el monitoreo de procesos y resultados por indicadores, análisis de incidencias y reuniones de coordinación semanales. Los procesos de apoyo sin dudas desempeñan un papel fundamental en la concreción de los procesos operativos. En cuanto a estos, todas las solicitudes de productos se reciben a través de la web. Posteriormente, se lleva a cabo una reunión entre las áreas de competencia con el propósito de definir el alcance del estudio a llevar adelante, así como identificar cuáles son los elementos que conformarán las preguntas PICO. Una vez acordado y confirmado el alcance, el tiempo de entrega y el presupuesto con el solicitante, se ejecutan los procesos correspondientes.
Estos procesos forman parte del Sistema de Gestión de la Calidad, el cual ha sido certificado acorde a la Norma UNIT-ISO 9001:2005, para brindar un servicio de información calificada de la evidencia científica sobre las tecnologías sanitarias, con el número de certificado CS 601.
Mapa de procesos de AETSU:
Transparencia:
Los profesionales de AETSU suscriben un documento de declaración de no conflictos de interés, así como un compromiso de confidencialidad a todos los participantes del proceso de evaluación.
De acuerdo con la normativa, la publicación de resultados o las evaluaciones completas son periódicas y se comunican a través del sitio web de AETSU.
 Argentina
Argentina La CONETEC invita a pacientes, cuidadores y usuarios del sistema de salud a participar de la Mesa de Pacientes. Las convocatorias de la Mesa de Pacientes están destinadas a pacientes, cuidadores, familiares y usuarios del sistema de salud interesados en aportar su visión sobre la tecnología de salud (medicamento, instrumento, técnicas y procedimientos clínicos y quirúrgicos) o la condición de salud que la CONETEC esté evaluando. La información que aportarán está referida a puntos de vista, opiniones y expectativas sobre: la experiencia de vida con la condición de salud, el cuidado de una persona con esa condición de salud, la experiencia de recibir atención en el sistema de salud argentino, los beneficios suministrados por un tratamiento, la magnitud de los efectos no deseados y la comparación con otros tratamientos, la aceptabilidad y preferencias de los diferentes tratamientos y sus modos de administración. Éstos pueden colaborar como individuos o desde asociaciones de pacientes desde la definición de la pregunta de investigación, a través de propuestas sobre desenlaces relevantes, como a través formularios y mesa técnica para aportar su perspectiva que quedan reflejados en el documento final.
La CONETEC invita a participar a las personas por medio de un formulario para cada ETS que se está evaluando. Guía para la Mesa de pacientes:https://www.argentina.gob.ar/salud/conetec/documentos-tecnicos
 Brasil
Brasil Los mecanismos de participación social utilizados por la Conitec durante el proceso de evaluación y toma de decisiones de incorporación de una tecnología son la Perspectiva del Paciente (Un paciente, familiar o cuidador presenta su informe en la reunión de la Conitec en el espacio «Perspectiva del paciente», con el fin de ofrecer la visión de los usuarios del SUS al relatar sus experiencias con la condición de salud en evaluación) consulta pública y la audiencia pública. Tanto la consulta pública como la audiencia pública son mecanismos de transparencia y publicidad (previstos en la legislación de Conitec) de que utiliza la Administración Pública del país para obtener información, opiniones y críticas de la sociedad sobre un tema determinado.
La Consulta Pública tiene como objetivo ampliar la discusión sobre el tema y apoyar decisiones sobre la formulación y definición de políticas públicas. Con el fin de promover la participación de la sociedad (pacientes, cuidadores, asociaciones, instituciones académicas, productores de tecnología, sociedades científicas, ciudadanos en general) en la toma de decisiones para la inclusión de medicamentos y otras tecnologías ajenas al SUS, Conitec pone sus recomendaciones a disposición para consulta pública por un período de 20 días. Excepcionalmente, este plazo se puede reducir a 10 días en situaciones de emergencia. Los ciudadanos acceden públicamente al informe técnico de la tecnología en cuestión, y pueden emitir sus sugerencias y comentarios sobre la tecnología evaluada o Guías de Práctica Clínica, así como sobre la recomendación inicial hecha por Conitec. Estos aportes deberán ingresarse en los formularios electrónicos disponibles en el portal del Conitec. En las consultas públicas sobre tecnologías sanitarias se ponen a disposición dos formularios electrónicos, uno para aportes técnico-científicos y otro para aportes con informes de experiencia u opinión. Los aportes son organizados e incluidos en los informes técnicos para su análisis por los miembros del Plenario del Conitec. Luego de discutir los aportes recibidos en las Consultas Públicas, los miembros del plenario emiten la recomendación final sobre la medicina/tecnología evaluada. El informe técnico con la recomendación de la Comisión se remite luego a la Secretaría de Ciencia, Tecnología, Innovación e Insumos Estratégicos del Ministerio de Salud (SCTIE/MS), quien decide si el fármaco/tecnología se incorporará al SUS.
Además, en el proceso de Evaluación de Tecnologías Sanitarias (ETS) del Ministerio de Salud, se prevé una audiencia pública, de conformidad con el art. 19-R de la Ley No. 8.080/1990, art. 21 del Decreto No. 7.646/2011, y art. 40 del Anexo XVI de la Ordenanza de Consolidación GM/MS No. 1/2017. Este proceso se da luego de la recomendación final del Conitec, cuando el informe técnico, que contiene la deliberación del Plenario, así como el acta de deliberación, son enviados a la Secretaría de Ciencia, Tecnología, Innovación e Insumos Estratégicos en Salud (SCTIE/MS) para decisión Final. Así, si el Secretario de la SCTIE/MS entiende que se necesitan más información que la contenida en el Informe de Recomendación del Conitec, podrá solicitar una audiencia pública para recabar la opinión de la sociedad antes de tomar su decisión.
Para mayor información: http://conitec.gov.br/; http://conitec.gov.br/consultas-publicas#cp
 Chile
Chile En relación al proceso ETS llevado a cabo para LRS, existen mecanismos específicos de participación social durante el proceso de evaluación de tecnologías y toma de decisiones para las partes potencialmente afectadas o interesadas: personas con estos problemas de salud y cuidadores, ciudadanos en general, productores de tecnologías, sociedades científicas, instituciones académicas. Una vez elaborado el informe de ETS la sociedad civil no puede formular observaciones sobre éstos.
Por otro lado, se elaboran Diálogos para Políticas Informados por Evidencia, donde se convocan a distintas organizaciones ciudadanas y científicas, entre otros grupos de interés, para deliberar y analizar alguna potencial política a implementar sobre la cual se haya analizado la evidencia existente.
 Costa Rica
Costa Rica La sociedad civil no puede formular observaciones sobra las recomendaciones de un informe de ETS. Tampoco existen mecanismos específicos de participación durante el proceso de evaluación de tecnologías y toma de decisiones para las partes potencialmente afectadas o interesadas.
Las conclusiones de los informes de ETS no son públicas.
 Ecuador
Ecuador Por el momento el Ministerio de Salud Pública no cuenta con mecanismos específicos que permitan la participación ciudadana durante el proceso de ETS o la toma de decisiones de cobertura. No obstante, la Ley Orgánica de Salud vigente, dentro del capítulo sobre derechos y deberes de las personas y del Estado en relación con la salud, declara que uno de sus derechos es «Participar de manera individual o colectiva en las actividades de salud y vigilar el cumplimiento de las acciones en salud y la calidad de los servicios, mediante la conformación de veedurías ciudadanas u otros mecanismos de participación social; y, ser informado sobre las medidas de prevención y mitigación de las amenazas y situaciones de vulnerabilidad que pongan en riesgo su vida».
 El Salvador
El Salvador No existen mecanismos formales de Participación Social durante la elaboración de los informes de ETS vinculados a los pacientes o a la sociedad civil en general. De todas formas, como iniciativa, se han realizado consultas públicas a través de la página web de la Dirección para algunos protocolos.
Para la elaboración de los informes de ETS se consulta a médicos especialistas en la temática a tratar.
La sociedad civil no cuenta con un mecanismo para formular observaciones sobre las recomendaciones de un informe de ETS.
 Guatemala
Guatemala No existen mecanismos formales de Participación Social durante la elaboración de los informes de ETS vinculados a los pacientes o a la sociedad civil en general.
La sociedad civil no cuenta con un mecanismo para formular observaciones sobre las recomendaciones de un informe de ETS.
 México
México El CENETEC no ha desarrollado al momento mecanismos específicos de participación durante el proceso de ETS y toma de decisiones para las partes potencialmente afectadas o interesadas.
 Paraguay
Paraguay Existen mecanismos específicos de participación durante el proceso de evaluación de tecnologías o toma de decisiones de cobertura para algunas de las partes potencialmente interesadas o afectadas como son las sociedades científicas y las instituciones académicas siendo integrantes partes del Comité Nacional de Farmacoterapia.
Para la creación del Comité Nacional de Farmacoterapia fueron convocados a los primeros talleres representantes de la sociedad civil, como asociaciones de pacientes, sociedades científicas, representantes de la Universidad Nacional de Asunción, a los que fue comunicado la iniciación del proceso, el cuál fue publicitado a nivel país en la página oficial del Ministerio de Salud y mediante cobertura de prensa.
La sociedad civil puede formular observaciones sobre las recomendaciones de un informe de ETS.
 Perú
Perú Al momento no existen mecanismos formales específicos de participación durante el proceso de evaluación de tecnologías o toma de decisiones de cobertura para las partes potencialmente interesadas o afectadas (ciudadanía, pacientes y cuidadores, profesionales de la salud, organizaciones, asociaciones profesionales, industria).
La sociedad civil no puede formular observaciones sobre las recomendaciones de un informe de ETS.
 República Dominicana
República Dominicana Al momento no existen mecanismos específicos de participación durante el proceso de evaluación de tecnologías o toma de decisiones de cobertura para las partes potencialmente interesadas o afectadas (ciudadanía, pacientes y cuidadores, profesionales de la salud, organizaciones, asociaciones profesionales, industria). Cuando se está en proceso de evaluación de una inclusión en el PBS (Plan Básico de Salud) si se toma en consideración las observaciones de las sociedades médicas, los grupos especializados y la asociación de pacientes, pero solo como mecanismo de participación y levantamiento de información, no como ente clave de decisión.
 Uruguay
Uruguay AETSU invita a organizaciones de pacientes, pacientes y usuarios del sistema de salud a participar de diferentes actividades llevadas a cabo por la Agencia, ya sean informativas como de consulta. A través de esta última se recaba su visión sobre la tecnología de salud o la condición de salud que se esté evaluando, la cual queda reflejada en el informe final. Las conclusiones de los informes de ETS se hacen públicas a través del sitio web de la Agencia.
 Argentina
Argentina Todos los tipos de infomes que realiza la comisión se llevan a cabo siguiendo la metodología establecida en el Manual de procedimiento para el funcionamiento de la CONETEC.
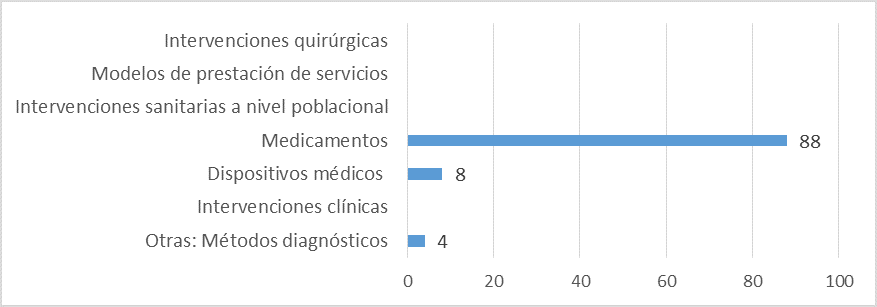
Fuente: Elaboración Propia a partir de la actualización 2024 de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
 Brasil
Brasil • Tipos de informes de ETS que se elaboran oficialmente: análisis críticos de las demandas externas de ETS, informes completos para demandas internas y externas de ETS, protocolos de uso, estudios de escaneo del horizonte tecnológico, revisión rápida, estudios prospectivos y retrospectivos, evaluación de desempeño, estudios de comparación indirecta, opinión técnico científica, revisiones sistemáticas, evaluaciones económicas y evaluaciones de impacto presupuestario.
• Cantidad de informes de ETS elaborados en el último año: 58 (2020)
Esta cantidad engloba las demandas correspondientes a todos los procesos que, recibidas en años anteriores o no, se completaron en 2020. Aquí se consideraron todas las recomendaciones publicadas en el Diario Oficial de la Unión durante 2020. Además, algunas demandas, aunque sean presentadas individualmente, son evaluadas conjuntamente por la Comisión, registradas en un solo informe.
• Porcentaje de acuerdo a tipo de TS:
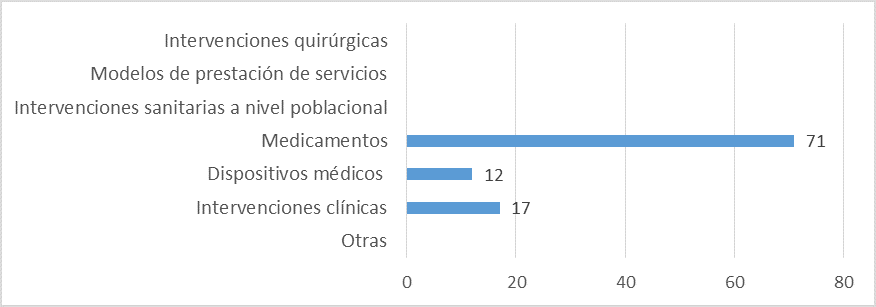
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
• Otros informes de ETS de organismos/instituciones del país:
– Centro Cochrane de Brasil
– Centro de Desarrollo Tecnológico en Salud (FIOCRUZ CDTS)
– Centro de Evaluación de Tecnologías Sanitarias – Instituto Sirio-Libanés de Enseñanza e Investigación Hospital Sirio-Libanés
– Hospital de Clínicas de Porto Alegre (HCPA)
– Hospital Alemán Oswaldo Cruz (HAOC)
– Hospital Base del Distrito Federal (HBDF)
– Hospital de Clínicas de la Facultad de Medicina de Botucatu (HCFMB)
– Hospital de Clínicas de la Facultad de Medicina de Ribeirão Preto (HCFMRPUSP)
– Hospital de Clínicas de la Facultad de Medicina de la Universidad de São Paulo (HCFMUSP)
– Hospital de Clínicas de la Universidad Estatal de Campinas (HC UNICAMP)
– Hospital Molinos de Viento (HMV)
– Instituto de Medicina Social de la Universidad Estatal de Río de Janeiro (IMS/UERJ)
– Instituto Nacional de Cardiología (INC)
– Instituto Nacional del Cáncer (INCA)
– Instituto Nacional de Traumatología y Ortopedía (INTO)
– Laboratorio de Salud Basada en Evidencias de la Escuela de Ciencias de la Salud – ESCS (LABSBE)
– Programa de Evidencias para Políticas y Tecnologías Sanitarias (FIOCRUZ PEPTS)
– Universidad Federal de lo Estado de Rio de Janeiro (UNIRIO)
– Universidad Federal do Paraná (UFPR)
– Universidad Federal de São Paulo (UNIFESP)
– Centro Colaborador do SUS para Evaluación de Tecnologías y Excelencia en Salud (CCATES)/ Universidad Federal de Minas Gerais (UFMG)
– Instituto de Ingenieria Biomédica/Universidad Federal de Santa Catarina (IEB/UFSC)*
– Agencia Nacional de Salud Suplementaria (ANS)
 Chile
Chile • Tipos de informes de ETS que se elaboran oficialmente: Evaluaciones de efectividad, Respuestas rápidas de cobertura, Revisiones sistemáticas, Evaluaciones económicas, Síntesis rápidas de evidencia, Resúmenes de evidencia para políticas y Diálogos para políticas informadas por evidencia.
• Cantidad de informes de ETS elaborados en el último año: 20
• Porcentaje de acuerdo a tipo de TS:
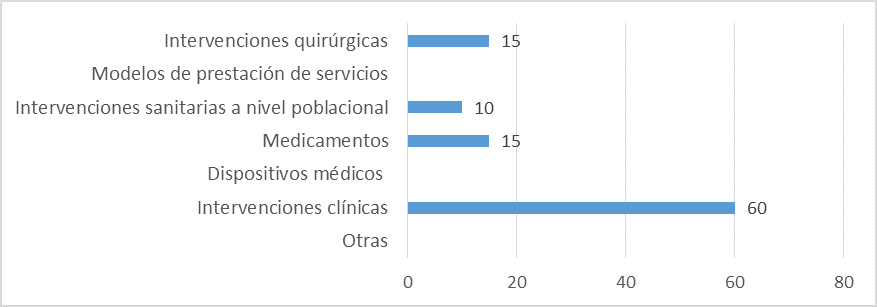
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
 Costa Rica
Costa Rica • Tipos de informes de ETS que se elaboran oficialmente: Evaluaciones de efectividad, Respuestas rápidas de cobertura, Revisiones sistemáticas, Evaluaciones económicas.
• Cantidad de informes de ETS elaborados en el último año: 50 informes elaborados por la CCSS (2019).
• Porcentaje de acuerdo a tipo de TS:
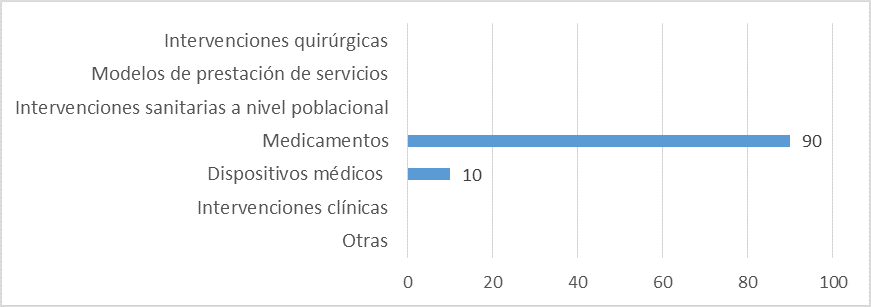
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
 Ecuador
Ecuador Bajo las atribuciones y responsabilidades de la Dirección Nacional de Inteligencia de la Salud y de la Dirección Nacional de Economía de la Salud se generan los siguientes insumos técnicos, mismos que no son vinculantes:
– Criterios Técnicos Basados en Evidencia
– Informes de Revisión Narrativa
– Informes rápidos de Evaluación de Tecnologías Sanitarias
– Informes Rápidos de Evidencia Científica
– Informes de Análisis de Impacto Presupuestario.
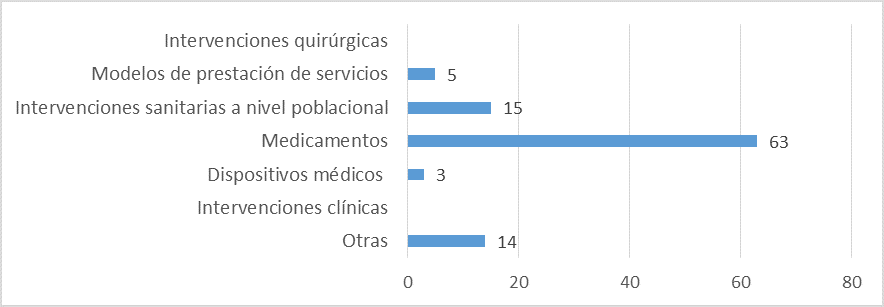
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
 El Salvador
El Salvador • Tipos de informes de ETS que se elaboran oficialmente: Evaluaciones de medicamentos.
• Cantidad de informes de ETS elaborados en el último año: 7 informes (2020)
• Porcentaje de acuerdo a tipo de TS:
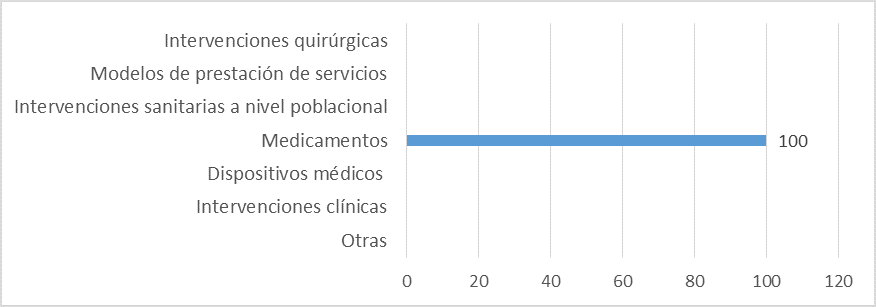
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
 Guatemala
Guatemala 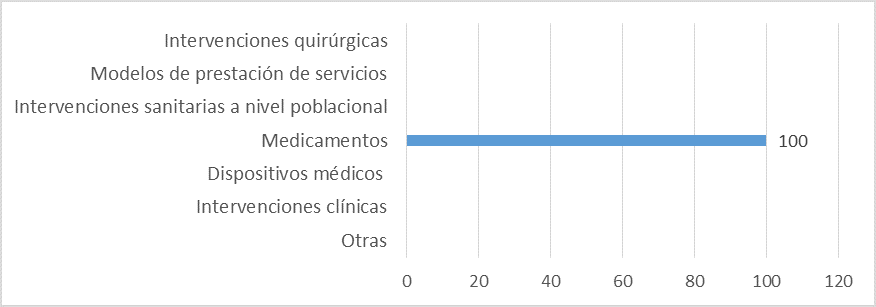
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2022.
 México
México
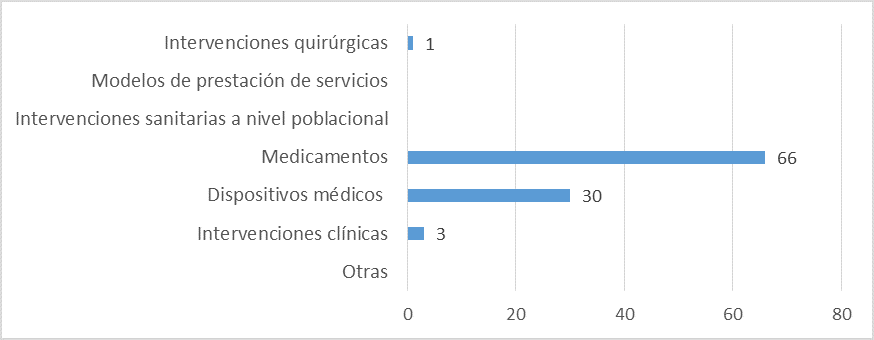
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
Los informes en extenso desarrollados por el CENETEC se pueden encontrar en: https://www.gob.mx/salud/cenetec/acciones-y-programas/conceptos-basicos-de-evaluacion-de-tecnologias-para-la-salud
 Paraguay
Paraguay 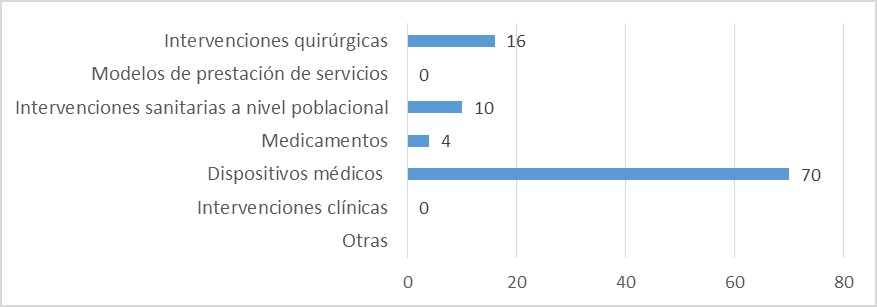
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
 Perú
Perú UNAGESP – INS:
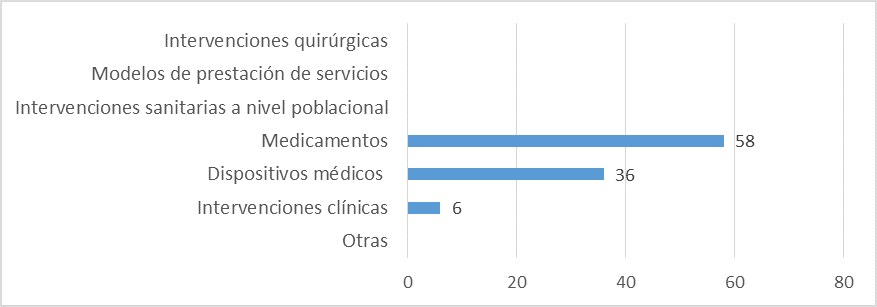
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
ESSALUD-IETSI:
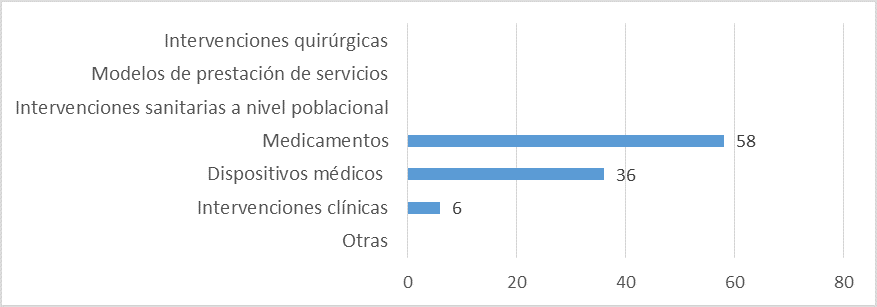
Fuente: Elaboración Propia a partir de los Resultados de la Encuesta de Enfoque integrado. OPS, 2019-2021.
Los informes de ETS se pueden encontrar en:
http://repositorio.digemid.minsa.gob.pe/handle/DIGEMID/21
http://www.essalud.gob.pe/ietsi/
 República Dominicana
República Dominicana
 Uruguay
Uruguay 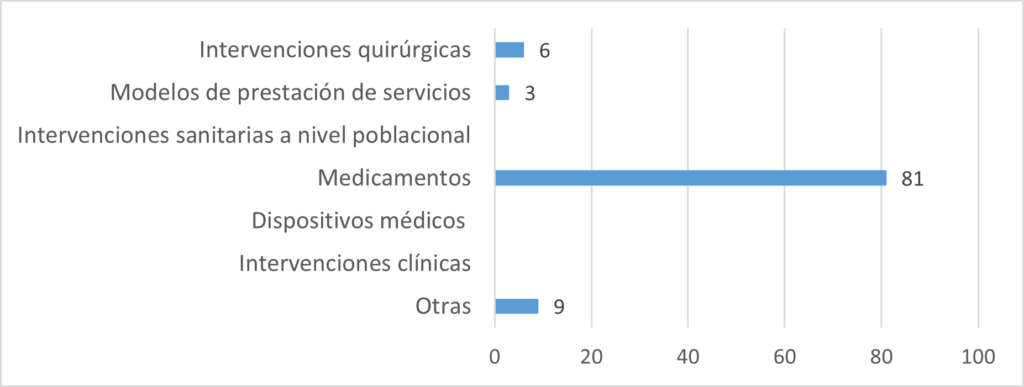
Fuente: Elaboración Propia a partir de los datos de AETSU, 2023.
– Informes de Real World Data, Fondo Nacional de Recursos.
 Argentina
Argentina El país establece mediante el Decreto N°344, que los resultados de la ETS realizadas por la CONETEC, deben ser tenidos en cuenta pero son solo vinculantes en la toma de decisiones para el Ministerio de Salud de la Nación y sus organismos desconcentrados y descentralizados, manteniendo la perspectiva de su análisis y alcance para los tres subsectores.
En primer lugar, para las tecnologías de salud que así lo requieran, la agencia reguladora del país (ANMAT) da aval e ingreso a las mismas para ser comercializadas en el país.
Los alcances de las coberturas en los diferentes subsistemas de salud coexistentes, las define cada subsector de financiamiento del país de acuerdo a definiciones propias (demanda, posibilidad de recupero de costos, protocolos propios de auditoría) no siempre basados en criterios taxativos de ETS.
Además, en la Argentina existen distintas leyes que obligan a la incorporación de determinadas Tecnologías de Salud. Son ejemplos las leyes de fibrosis quística, celiaquía, reproducción asistida y obesidad.
A estas leyes también se suman los casos de judicialización del derecho a la salud que son crecientes en Argentina en los últimos tiempos. Casos que, si bien pueden tener efectos positivos individualmente en los litigantes, no se traslada a todas las personas con el mismo problema de salud por lo cual no mejoran el acceso y equidad del sistema de salud. No menos importante que pueden tener incidencia en el uso de los recursos del sistema de salud sin planificación, determinando que se atiendan demandas no prioritarias.
 Brasil
Brasil La norma establece que los resultados de la ETS deben ser tenidos en cuenta y son vinculantes en la toma de decisiones de acuerdo a la Ley 12401 y al Decreto 7646, ambos de 2011.
El Plenario es el foro encargado de emitir una recomendación sobre la incorporación, exclusión o cambio de tecnologías dentro del SUS, sobre la constitución o cambio de protocolos clínicos y guías terapéuticas y actualización del Listado Nacional de Medicamentos Esenciales – Rename, que fue establecido por Decreto N° 7.508, de 28 de junio de 2011.
Todas las recomendaciones emitidas por el Plenario se someten a Consulta Pública (CP) por un período de 20 días. Los aportes y sugerencias de la consulta pública se organizan, evalúan e incluyen en el informe final del Conitec, que luego se remite a la Secretaría de Ciencia, Tecnología, Innovación e Insumos Estratégicos de Salud (SCTIE/MS) para la toma de decisiones. El Secretario de la SCTIE también podrá solicitar la realización de una audiencia pública previa a su decisión final.
Flujo de incorporación de una Tecnología de Salud:
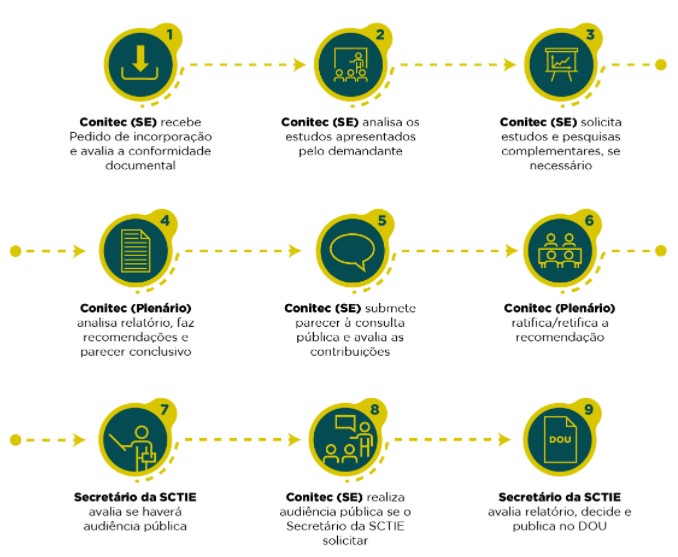
Las Recomendaciones finales de la Conitec y la decisión de SCTIE/MS son públicas y se pueden encontrar en: http://conitec.gov.br/decisoes-sobre-incorporacoes
Además, en Brasil al igual que en varios países de América Latina, se advierte una creciente judicialización de reclamos en materia de salud, principalmente en referencia a medicamentos de alto costo y a través de tribunales a nivel federal, estatal y municipal. Si bien pueden tener efectos positivos individualmente en los litigantes, no se traslada a todas las personas con el mismo problema de salud por lo cual no mejoran el acceso y equidad del sistema de salud. Asimismo, pueden tener incidencia en el uso de los recursos del sistema de salud sin planificación, determinando que se atiendan demandas no prioritarias.
 Chile
Chile El país establece por Resolución Ministerial que los resultados de las ETS para ciertas Tecnologías de salud (Tratamientos de alto costo de Ley Ricarte Soto) son vinculantes en la toma de decisiones. Para mayor información: https://www.leychile.cl/Navegar?idNorma=1078148 , https://www.minsal.cl/comision-recomendacion-priorizada-ley-ricarte-soto/
En relación al resto de las Tecnologías Sanitarias, las derivadas principalmente de las Garantías Explicitas de Salud, como se menciona anteriormente, los procesos no están formalizados bajo una ley o reglamento, pero el Departamento trabaja para homogeneizar estos procesos de ETS a lo establecido en la Ley Ricarte Soto.
El proceso de ETS ha sido progresivo en los distintos sistemas de cobertura. De esta forma, existen algunos programas de cobertura donde aún no hay institucionalizado un sistema de ETS propiamente como tal. Los alcances de las coberturas en los diferentes subsistemas de salud coexistentes, de acuerdo a la demanda, posibilidad de recupero de costos, protocolos propios de auditoría, no para todas las tecnologías son basados en criterios taxativos de ETS.
En lo que respecta a procesos de judicialización, en los últimos años se observa en el sistema público una posición pro tutela de los reclamos y la Corte Suprema ha obligado a la autoridad sanitaria a otorgar la cobertura de determinados medicamentos, mientras que en el sistema privado los reclamos se centran en el reajuste anual de los planes de salud y en el alza de los costos de dichos planes por razones de sexo, edad.
 Costa Rica
Costa Rica No existe una norma que establece que los resultados de la ETS deben ser tenidos en cuenta o que establezca que son vinculantes en la toma de decisiones para la incorporación de tecnologías sanitarias que no sean medicamentos.
La toma de decisiones en salud se realiza de acuerdo a aspectos de carácter político, de equidad y las necesidades percibidas por la sociedad.
En el caso específico de los medicamentos, existe un Comité Central de Farmacoterapia que sesiona ordinariamente una vez por semana, constituido por médicos y farmacéuticos de los 3 niveles de atención cuya función es la actualización del Formulario Terapéutico Nacional. El Comité tiene como brazo operativo a la Dirección de Farmacoepidemiología y sus dos áreas operativas: Área de Medicamentos y Terapéutica Clínica y Área de Fármaco-economía. Para la toma de decisiones sobre medicamentos, se emplean como insumos productos de evaluación de tecnología preparados por la Dirección.
Respecto a procesos de judicialización de la cobertura de salud, Costa Rica tiene un alto número de reclamos judiciales tratados por la Sala Constitucional mediante recursos de amparo, habiéndose destacado que el impacto de la jurisprudencia constitucional en la partida presupuestaria específica para medicamentos asciende al 10% anual. Posee un sistema de seguimiento de cumplimiento de las sentencias, obligación que está a cargo de la Caja de Seguro Social.
 Ecuador
Ecuador El país establece que los resultados de la ETS deben ser tenidos en cuenta pero no son vinculantes en la toma de decisiones. Se cree que en menos del 50% de los casos se tienen en cuenta en la toma de decisiones de cobertura las conclusiones de los informes de ETS. La toma de decisiones se basa también los derechos de los ciudadanos a partir de sus necesidades, políticas institucionales e interés nacional. En la decisión también se tiene en cuenta si la Tecnología de salud en cuestión está incluida ya en GPC del país.
En Ecuador existen dos vías de incorporación de medicamentos dentro del Sistema Nacional de Salud:
La primera, a través de la publicación del Cuadro Nacional de medicamentos Básicos (https://www.salud.gob.ec/cuadro-nacional-de-medicamentos-basico-cnmb/) que incluye un listado de medicamentos esenciales que tienen como objetivo cubrir las necesidades de atención en salud prioritarias de la población; y, su selección se realiza tomando en consideración la prevalencia de las enfermedades, su seguridad, eficacia y costo-eficacia. La elaboración del CNMB esta a cargo del Consejo Nacional de Salud (CONASA), organismo independiente al MSP pero conformado por representantes de los integrantes del Sistema Nacional de Salud (entidades públicas, privadas, autónomas y comunitarias del sector salud) y se lo lleva a cabo mediante un proceso participativo técnico – científico.
Los medicamentos incluidos en el CNMB deben estar disponibles en todo momento, en cantidades suficientes, en formas farmacéuticas apropiadas y con calidad garantizada.
El segundo mecanismo de incorporación de medicamentos es la vía excepcional para lo cual se debe cumplir con lo dispuesto en el “Reglamento sustitutivo para autorizar la adquisición de medicamentos que no constan en el Cuadro Nacional de Medicamentos Básicos – CNMB vigente” (https://www.salud.gob.ec/wp-content/uploads/2013/01/R.O.160.pdf).
Bajo este segundo mecanismos la instancia responsable de la toma de decisiones sobre la autorización o no de adquisición de medicamentos que no forman parte del CNMB es el “Comité para Autorizar o No Autorizar la Adquisición de Medicamentos que no Constan en el CNMB vigente (CAAME)”, instancia conformada por altas autoridades del Ministerio de Salud y otros actores de la RPIS. Durante el proceso de deliberación, el Comité evalúa los informes técnicos de ETS, la exposición de expertos y otros criterios proporcionados por diferentes instancias internas del Ministerio de Salud (Subsecretaría Nacional de Gobernanza, planificación, calidad de los servicios). Adicionalmente, los tomadores de decisión consideran las prioridades del sistema de salud, políticas institucionales, experiencias previas en el país con el uso de la tecnología, temas de equidad y otros.
En los últimos años se ha observado un incremento en el número de demandas judiciales que exigen la cobertura de medicamentos que por lo general son de alto impacto presupuestario, mecanismo que se ha convertido en una tercera vía de exigir acceso a medicamentos que no forman parte del CNMB por parte de los ciudadanos en su justo y legitimo derecho, de tal modo que el 05 de agosto de 2020 la Corte Constitucional del Ecuador emitió la sentencia Nro. 679-18-JP/20 y acumulados sobre el derecho a medicamentos de calidad, seguros y eficaces a través del cual dispone al Ministerio de Salud tomar diferentes acciones con el fin de salvaguardar el derecho al acceso a medicamentos para el disfrute de más alto nivel posible de salud.
 El Salvador
El Salvador Los resultados de la ETS deben ser tenidos en cuenta pero no son vinculantes en la toma de decisiones. Los informes de ETS son tenidos en cuenta en algunos casos, no más del 50%.
El Reglamento General de Hospitales en el art. Art. 176.- “… La actualización o modificación del Listado Complementario Institucional será normada por el Manual de Procedimientos para Inclusión, Exclusión y Modificación de Medicamentos emitido por el MINSAL.”
El Manual de Funciones de Comités Farmacoterapéutico Institucional.
“2.1 Asesorar a la DIRTECS en el establecimiento de las directrices relativas a la selección de los medicamentos esenciales y vitales, teniendo en cuenta los principios de Medicina Basada en Evidencia (MBE), además de utilizar la información científica de fuentes confiables referente a eficacia, seguridad, calidad y el consecuente análisis fármaco económico.
2.2 Analizar, evaluar y resolver las solicitudes de inclusión, modificación y exclusión de medicamentos al Listado oficial, propuestos por los Comités de farmacoterapéuticos Regionales y Hospitalarios de los establecimientos de salud de la red del MINSAL, Programas Nacionales de Salud, Unidades de Atención Integral en Salud y otros.”
Los informes de ETS con sus respectivas recomendaciones son presentados y será el titular quién autorizará o no su inclusión, modificación o exclusión a los listados institucionales, dándose posteriormente la adenda respectiva a los listados anteriormente referidos.
La toma de decisiones en salud generalmente se vincula a la respuesta de la prestación de los servicios de salud.
 Guatemala
Guatemala No existe a nivel nacional, ninguna entidad que evalúe las necesidades de inclusión, exclusión o modificación de tecnologías sanitarias, pero el IGSS inició en el año 2018 la incorporación de la ETS para medicamentos.
Para el subsector de la seguridad social, los resultados de la ETS de medicamentos deben ser tenidos en cuenta pero no son vinculantes en la toma de decisiones.
Para el subsector público no hay normas que regulen el mecanismo de incorporación de TS.
La toma de decisiones en salud generalmente se vincula a la problemática social y política y a procesos de judicialización de la salud.
 México
México El Consejo de Salubridad General (CSG) es un órgano colegiado que depende directamente del presidente de la República y tiene el carácter de autoridad sanitaria. Una de las funciones del CSG, es la de elaborar, actualizar y difundir el Compendio Nacional de Insumos para la Salud (CNIS), la instrumentación de este proceso se lleva a cabo, a través de la Comisión Interinstitucional del Cuadro Básico y Catálogo de Insumos del Sector Salud (CICBCISS), mediante un proceso sustentado en criterios de transparencia, de eficiencia, e incorporando la evidencia de los avances de la ciencia y la tecnología en medicina para fomentar la calidad y el uso racional de los insumos en las instituciones públicas del Sistema Nacional de Salud.
La Comisión, cuenta con ocho Comités Técnicos Específicos, enfocados a analizar Medicamentos, Material de Curación, Auxiliares de Diagnóstico, Instrumental y Equipo Médico, Osteosíntesis y Endoprótesis, Nutriología, Herbolarios y Medicamentos Homeopáticos; todos los comités están integrados por el Secretario Técnico de la Comisión y un representante de las diferentes instituciones que conforman el sistema público de salud, se consideran como invitados permanentes a la COFEPRIS y al CENETEC quienes cuentan con voz, pero no con voto.
El proceso de actualización del CNIS, se lleva a cabo en tres etapas: i) revisión y valoración de la solicitud, ii) evaluación de la evidencia, iii) valoración y dictamen. Las solicitudes de actualización se clasifican en inclusión (insumos a los que se les asignará una nueva clave para formar parte del Compendio), modificación (insumos contenidos en el compendio y se solicitan cambios ya sea por tipo de presentación, indicación terapéutica, aplicaciones, especificaciones o accesorios sin que se produzcan diferencias sustantivas de los insumos contenidos) y exclusión (proceso para desincorporar insumos que sean obsoletos, no seguros y que sean desplazados por opciones más costo-efectivas).
Conforme al Artículo 38 Bis del Artículo 38 Bis del Reglamento de la CICBCISS, la Comisión podrá solicitar al Centro Nacional de Excelencia Tecnológica en Salud; su opinión técnica respecto de las solicitudes de actualización relacionadas con insumos que incidan en su ámbito de competencia. El Centro Nacional de Excelencia Tecnológica en Salud, emitirá su opinión técnica por escrito, en un plazo no mayor a cuarenta días hábiles, contados a partir del día siguiente a la fecha en la que la Comisión haya solicitado dicha opinión técnica, sin que la misma tenga el carácter de vinculante. Los informes elaborados por el CENETEC son remitidos a los integrantes de los comités para que sean considerados en sus deliberaciones y toma de decisiones para la actualización del Compendio Nacional de Insumos para la Salud.
Del mismo modo, el Artículo 41 del Reglamento de la CICBCISS, indica que: en el caso de solicitudes de inclusión en las que el insumo no se ajuste a los criterios establecidos en la Guía de Evaluación de Insumos para la Salud en cuanto su relación de costos y efectos en salud, éste no podrá ser incorporado al Cuadro Básico y Catálogo.
No obstante, lo anterior, el Comité que conozca de la solicitud de inclusión, podrá emitir un dictamen favorable, debidamente motivado haciendo explícitas las razones que lo fundamenten en alguno de los siguientes aspectos:
I. La necesidad de los pacientes de la enfermedad a la que va dirigido el insumo;
II. Los programas de salud de las instituciones;
III. El impacto que el nuevo insumo tendrá en la organización de los servicios de salud de las instituciones, y
IV. El beneficio potencial a largo plazo que la incorporación del insumo puede presentar.
Tratándose de los casos de excepción previstos en las fracciones anteriores, el Comité que conozca de la solicitud de inclusión, instará al solicitante a recopilar mayor información sobre los efectos de mediano y largo plazo de los insumos para la salud, lo que deberá evaluarse por el propio Comité previamente al otorgamiento del dictamen favorable.
 Paraguay
Paraguay Al momento el país no cuenta con un proceso oficial de recolección de evidencia y elaboración de ETS como insumo para la toma de decisiones de cobertura de salud. La Norma establece que los resultados de ETS deben tenerse en cuenta pero no son vinculantes en la toma de decisiones. Las decisiones se toman teniendo en cuenta las necesidades y demandas de la sociedad y el costo-beneficio de la cobertura de dicha tecnología sanitaria.
 Perú
Perú La DIGEMID en su rol de agencia regulatoria, es la encargada de evaluar las tecnologías sanitarias para comercialización en el país, así, esta autoridad aprueba el registro sanitario de las tecnologías que cumplan los requisitos exigidos.
En el sector público el uso de productos farmacéuticos, dispositivos médicos y otros productos sanitarios se rigen a través de la Ley 29459 y, existen lineamientos que exigen una toma de decisiones basadas en evaluaciones de tecnologías sanitarias, así, la inclusión de cualquier producto farmacéutico al Petitorio Nacional Único de Medicamentos Esenciales del país exige de una ETS para la toma de decisión de su inclusión, del mismo modo para autorizar el uso de un producto que no se encuentre dentro de este Petitorio, también se requiere de una ETS para la toma de decisión, esto esta delineado en la Política Nacional de Medicamentos del año 2004 aprobado con Resolución Ministerial N° 1240-2004/MINSA y en el numeral 6.1 de la Directiva administrativa N° 249-MINSA/2018/DIGEMID Gestión del sistema integrado de suministro público de productos farmacéuticos, dispositivos medios u productos sanitarios-SISMED”. Con respecto a tecnologías sanitarias para el diagnóstico, tratamiento y prevención de enfermedades raras o huérfanas de alto costo, el Decreto Supremo N° 004-2019 exige una ETS de la RENETSA para la toma de decisión (incluye solicitudes de productos farmacéuticos y dispositivos médicos).
En el subsector de la seguridad social los informes de ETS de productos farmacéuticos, dispositivos médicos y otras tecnologías relacionadas son vinculantes en la toma de decisiones de cobertura de salud. Para mayor información: http://www.essalud.gob.pe/ietsi/pdfs/normas/Compendio_Normativo.pdf
En UFETS el marco de valor de incorporación de una tecnología contempla: magnitud del beneficio clínico (efectividad), calidad de la evidencia, impacto en salud pública, severidad de la enfermedad, impacto en la equidad, costo efectividad y análisis de impacto presupuestario. Estos dos últimos no desarrollados con data local sino extrapolados de lo realizado en otros países.
 República Dominicana
República Dominicana Al momento el país no cuenta con un proceso oficial de recolección de evidencia y elaboración de ETS como insumo para la toma de decisiones de cobertura de salud. Las decisiones no se toman teniendo en cuenta las ETS, sino de acuerdo a análisis estadísticos, actuariales y aproximaciones de precios de mercado. No existe la figura específica para evaluación de tecnología aún en el país, pero es el Consejo Nacional de la Seguridad Social (CNSS) el órgano rector del Sistema que aprueba la incorporación de nuevas coberturas al catálogo a partir de las propuestas remitidas desde la Superintendencia de Salud y Riesgos Laborales (Ley 8701 art 176). La SISALRIL participa, pero no tiene voto en el CNSS.
Hasta la fecha, las tomas de decisión sobre las tecnologías a incorporar se han realizado en respuesta a la demanda, influenciada por la prescripción médica y esta a su vez por la industria farmacéutica. La SISALRIL ha tomado como punto de partida los reclamos de los afiliados, y sobre esta base se han realizado las propuestas de incorporación de tecnologías. Estas propuestas son remitidas al CNSS, esta a su vez pasa a la Comisión de Salud y de Presupuesto, Finanzas e Inversiones; las mismas emiten sus recomendaciones y en lo adelante se aprueba la incorporación de la tecnología.
El actual catálogo de prestaciones del Plan de Servicios de salud aprobado ha sido modificado de manera parcial en el tiempo, predominantemente mediante la inclusión de nuevas tecnologías o coberturas sin considerar criterios claros de priorización de intervenciones o comportamientos epidemiológicos de la población ni criterios de coto efectividad.
 Uruguay
Uruguay La norma (Resolución del Ministerio de Salud) establece que los resultados de la ETS deben ser tenidos en cuenta, pero no son vinculantes en la toma de decisiones para el Ministerio de Salud Pública.
Respecto a los informes realizados por AETSU, la norma actual no establece vínculo acerca de los resultados de la ETS respecto a la toma de decisiones del regulador. Acorde a la ley vigente, AETSU no participa en el proceso de toma de decisión de incorporación de TS.
Cada producto generado es entregado a quien lo solicitó y es éste quien define el fin último de la evaluación.
En caso de tratarse del Ministerio de Salud Pública (MSP), éste es quién define si la tecnología ingresa al PIAS (Plan Integral de Atención a la Salud, PIAS). Las tecnologías que ingresen al PIAS son la base obligatoria para la prestación a los pacientes, una excepción son las de alto costo que se canaliza su aprobación y entrega a través del FNR.
El proceso de ingreso al PIAS contempla los criterios de equidad, ética y justicia social, asegurando la universalidad en el acceso.
Aquellas prestaciones que no ingresan al PIAS pero que están registradas a nivel nacional, son incorporadas al vademécum de prestadores a discreción de éstos.
Los informes de ETS y recomendaciones realizadas son tenidos en cuenta en la toma de decisiones de cobertura en casi todos los casos, entre el 70 y 99%. En los casos que la toma de decisiones de cobertura no se refiere a las ETS fundamentalmente es debido a que rigen Leyes aprobadas por el Parlamento.
Respecto a la judicialización de los procesos de cobertura de salud en Uruguay, se advierte un bajo nivel de judicialización en relación con algunos otros países de América Latina. Podría deberse en alguna medida a la amplia lista de medicamentos y prestaciones consideradas como priorizadas en el sistema de salud uruguayo, así como también a los mecanismos de revisión y criterios de inclusión utilizados para garantizar las coberturas. La mayoría de los reclamos son para la cobertura de medicamentos de alto costo. No obstante, en los últimos años se ha detectado un incremento de las demandas y mayor flexibilidad judicial en su tratamiento.
 Argentina
Argentina El sistema de salud está en línea con la organización federal. Lo integran tres sectores: público, seguro social y privado. En cada provincia se administran con autonomía las funciones de rectoría, financiamiento y prestación de los servicios de salud. Su estructura se encuentra fragmentada y segmentada.
El sector público está conformado por los ministerios nacional y provinciales, y en muchas jurisdicciones la responsabilidad es de los distintos municipios, y la red de hospitales y centros de salud públicos correspondientes. Todos ellos prestan atención gratuita a quien lo demande, fundamentalmente a las personas en los quintiles de ingresos más bajos, sin seguridad social y sin capacidad de pago. Su financiamiento se acerca a 2,2% del producto interno bruto (PIB) pero es muy variable entre las distintas provincias del país.
El sector del seguro social obligatorio está organizado en torno a las obras sociales, nacionales y provinciales. Las obras sociales nacionales son más de 200, e implican un gasto de 1,59% del PIB, y las 23 obras sociales provinciales cubren a los empleados públicos de su jurisdicción, abarcando 0,74% del PIB, nuevamente con inversiones dispares entre provincias. El Instituto Nacional de Servicios Sociales para Jubilados y Pensionados cubre a las personas jubiladas del sistema nacional de previsión y a sus familias. Su cobertura ha alcanzado a 20% de la población, con un gasto que llega a 0,75% del PIB.
El sector privado está conformado por profesionales de la salud y establecimientos que atienden a demandantes individuales, además de los beneficiarios de las obras sociales y de los seguros privados.
Todas las obras sociales y el sector privado deben garantizar un conjunto de prestaciones de salud agrupadas en el Programa Médico Obligatorio (PMO): https://www.sssalud.gob.ar/pmo/res_201.php
El país cuenta con un Listado de Medicamentos Esenciales (LME) acorde a las recomendaciones de la OMS y actualizado, aunque no existe una exigencia legislativa para que los medicamentos seleccionados para la LME deban ser incluidos entre aquellos con cobertura garantizada en los conjuntos de prestaciones además de que varias provincias tienen sus propios Listados de Medicamentos.
 Brasil
Brasil El sistema de salud pública es universalmente accesible y disponible para todos los ciudadanos brasileños, sin embargo, está compuesto por un sector público que cubre alrededor de 70% de la población y un sector privado que ofrece atención a la salud al restante 30% de los brasileños. Alrededor del 20-25% tiene acceso a planes de salud.
La gestión del sistema es compartida por el Ministerio de Salud federal, las secretarías estatales de salud y las secretarías municipales de salud. El financiamiento se obtiene a partir de impuestos y contribuciones de los estados y municipios. El Sistema Único de Salud (SUS) se creó con la Constitución Federal de 1988, siendo sus principios el acceso universal e integral a los servicios de salud, la promoción de la equidad, la descentralización de la gestión y la participación social.
Existe en el país un listado público de las tecnologías de salud incorporadas desde 2012 (cuando comienza el trabajo de la Conitec) incluyendo las razones de esas incorporaciones: http://conitec.gov.br/decisoes-sobre-incorporacoes
Todos los efectores de salud del SUS de acuerdo a su nivel de complejidad deben garantizar el conjunto de prestaciones y medicamentos establecidos por el Ministerio de Salud.
El país cuenta con un Listado de Medicamentos Esenciales – Rename – acorde a las recomendaciones de la OMS y actualizado, y existe una exigencia legislativa para que los medicamentos seleccionados para la Rename deban ser incluidos entre aquellos con cobertura garantizada en los conjuntos de prestaciones.
 Chile
Chile El sistema de salud de Chile es de carácter mixto e incluye aseguramiento público, a través del Fondo Nacional de Salud (FONASA), privado por medio de las instituciones de salud previsional (ISAPRE) y de otros seguros específicos, como los de las Fuerzas Armadas. En el 2013, 76,3% de la población pertenecía a FONASA y 18,1% a alguna ISAPRE. La gobernanza y la regulación del Sistema son ejercidas por el Ministerio de Salud, que también es responsable del marco regulatorio. El Sistema Nacional de Servicios de Salud (SNSS) coordina las funciones del sector público prestador, compuesto de 29 servicios descentralizados, distribuidos entre las 15 regiones del país, y el sistema de atención primaria, principalmente municipal.
El Régimen General de Garantías en Salud, establecido en la Ley 19966 de agosto de 2004, es un instrumento de regulación sanitaria que forma parte integrante del Régimen de Prestaciones de Salud a que se refiere el artículo 4º de la ley Nº18.469, elaborado de acuerdo al Plan Nacional de Salud y a los recursos que disponga el país. Establece las prestaciones de carácter promocional, preventivo, curativo, de rehabilitación y paliativo, y los programas que el Fondo Nacional de Salud deberá cubrir a sus respectivos beneficiarios, en su modalidad de atención institucional, conforme a lo establecido en la ley Nº 18.469. El Régimen General de Garantías contiene las Garantías Explícitas en Salud (GES) relativas a acceso, calidad, protección financiera y oportunidad con que deben ser otorgadas las prestaciones asociadas a un conjunto priorizado de programas, enfermedades o condiciones de salud que señale el decreto correspondiente. Actualmente, se encuentran incorporados a este Sistema de Garantías los 85 problemas de salud. El Fondo Nacional de Salud y las Instituciones de Salud Previsional deben asegurar obligatoriamente dichas garantías a sus respectivos beneficiarios. Las personas que cumplen las condiciones establecidas por el AUGE acceden a una canasta de servicios de acuerdo a su problema de salud llamado “listado específico de prestaciones”.
A través de la Ley Ricarte Soto (ley 20850), publicada en 2015, se crea un Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo. La Ley busca asegurar el financiamiento de diagnósticos y tratamientos basados en medicamentos, dispositivos médicos y alimentos de alto costo con efectividad probada, que muchas veces suelen tener costos inalcanzables para las personas y sus familias. Sus beneficiarios son todas las personas que se encuentran adscritas a un Sistema Previsional de Salud en Chile. Esto es, cotizantes de FONASA, ISAPREs, y de las Fuerzas Armadas y de Orden (CAPREDENA y DIPRECA). Los Ministerios de Salud y de Hacienda, fijan por decreto supremo, un umbral de costo anual que define universalmente el monto sobre el cual se considera que un diagnóstico o un tratamiento es de alto costo. A partir de esta Ley, se cubre el 100% del valor de los medicamentos, dispositivos médicos o alimentos de alto costo, que se encuentran expresamente garantizados para cada problema de salud definido, según el decreto que los fija.
El país cuenta con un listado público de los medicamentos y otras tecnologías incorporadas en el paquete de beneficios, incluyendo las razones que llevaron a esta decisión.
El país cuenta con un Listado de Medicamentos Esenciales (LME), en Chile denominado Formulario Nacional de Medicamentos, acorde a las recomendaciones de la OMS , aunque no existe una exigencia legislativa para que los medicamentos seleccionados para el LME deban ser incluido entre aquellos con cobertura garantizada en los conjuntos de prestaciones, estos debe estar disponibles en el país para toda la población que lo requiera, además, los productos farmacéuticos que constituyen el Formulario Nacional de Medicamentos, serán de existencia obligatoria en farmacias, respecto de los petitorios (que son una parte del formulario) los cuales son reglamentariamente exigibles. El formula nacional de medicamentos se encuentra constantemente en proceso de revisión a cargo de la Comisión Permanente de Actualización del Formulario Nacional de Medicamentos, entidad que tiene como principal función, proponer cada dos años al Ministro de Salud, la nómina actualizada de medicamentos del Formulario Nacional.
Cabe destacar que los programas nacionales de cobertura exceden ampliamente el contenido del formulario nacional. Para mayor información: https://www.supersalud.gob.cl/
 Costa Rica
Costa Rica El sistema sanitario nacional está conformado por el sector de la salud estatal, los servicios de atención privados, las organizaciones comunitarias orientadas a la salud, las universidades, las municipalidades, las compañías farmacéuticas, la Comisión Nacional de Emergencias y los organismos de cooperación internacional. El sector público de salud está integrado por el Ministerio de Salud, la Caja Costarricense de Seguro Social, el Instituto Costarricense de Acueductos y Alcantarillados y otras instituciones públicas encargadas de proteger y mejorar el estado de la salud de la población. El Ministerio, como ente rector del sistema, cumple funciones de dirección y conducción política, regulación sanitaria, direccionamiento de la investigación, medicamentos y desarrollo tecnológico. Cabe destacar que el financiamiento del seguro de salud tiene una base contributiva; el objetivo es avanzar en la universalidad del financiamiento, sin descuidar el posible impacto de las nuevas modalidades de empleo en la sostenibilidad financiera del seguro de salud.
La Caja Costarricense de Seguro Social es el mayor proveedor de servicios de salud y presta servicios integrales a sus asegurados, desde la promoción de la salud hasta los cuidados paliativos. No existen copagos en la seguridad social. En el 2013, la cobertura del seguro social de salud fue de 84,9%.
El país cuenta con un Listado de Medicamentos Esenciales (LME) acorde a las recomendaciones de la OMS y actualizado llamado Listado Oficial de Medicamentos (LOM), aunque no existe una exigencia legislativa para que los medicamentos seleccionados para la LME deban ser incluidos entre aquellos con cobertura garantizada en los conjuntos de prestaciones.
 Ecuador
Ecuador En la Constitución del 2008, se sentaron las bases para un nuevo Sistema de Salud basado en tres pilares: el Estado garante del derecho a la salud; un sistema basado en la atención primaria de salud y la creación de una red pública integrada de servicios gratuitos de salud, estableciendo que «la salud es un derecho que garantiza el Estado” y que “la prestación de los servicios de salud se regirá por los principios de equidad, universalidad, solidaridad, interculturalidad, calidad, eficiencia, eficacia, precaución y bioética, con enfoque de género y generacional».
De forma general, un Sistema Nacional de Salud (SNS) incluye como parte de sus funciones: la Rectoría, el Financiamiento/Aseguramiento y la Provisión de servicios de salud. El Ministerio de Salud Pública (MSP) en la función de Rectoría es el responsable de la conducción de la política y regulación sectorial, y de manera similar, en la función de provisión de servicios de salud es responsable entre otras actividades, de las tecnologías sanitarias.
Para cumplir su rol regulatorio, la autoridad sanitaria dispone adicionalmente de dos entidades adscritas con diferentes roles, así la Agencia Nacional de Regulación, Control y Vigilancia Sanitaria (ARCSA) (https://www.controlsanitario.gob.ec) es el organismo técnico encargado de la regulación, control técnico y vigilancia sanitaria de productos de uso y consumo humano y la Agencia de Aseguramiento de la Calidad de los Servicios de Salud y Medicina Prepaga (ACESS) (http://www.calidadsalud.gob.ec) institución encargada de ejercer la regulación técnica, control técnico y la vigilancia sanitaria de la calidad de los servicios de salud públicos, privados y comunitarios, con o sin fines de lucro.
El SNS del Ecuador está fragmentado en tres subsistemas: 1) MSP, 2) seguridad social que incluye: Seguridad Social General y Seguro Social Campesino, Seguridad Social del Ministerio de Defensa Nacional, y Seguridad Social del Ministerio de Gobierno, los cuales comprenden sus respectivos Institutos: Instituto Ecuatoriano de Seguridad Social- IESS; Instituto de Seguridad Social de Fuerzas Armadas- ISSFA, e Instituto de Seguridad Social de la Policía Nacional-ISSPOL y 3) Prestadores privados. El subsistema privado lo componen las entidades con fines de lucro (hospitales, clínicas, dispensarios, consultorios, farmacias y empresas de medicina prepagada) y organizaciones no lucrativas de la sociedad civil y de servicio social.
El MSP ofrece servicios de atención de salud a toda la población, con la provisión más amplia de servicios del país, y cubre alrededor del 60.3% de la población ecuatoriana. Los trabajadores del sector formal de la economía tienen derecho a afiliarse a una de las instituciones de seguridad social, así el IESS cubre al 23.58% del total de la población ecuatoriana y al 4.23% de la población a través del seguro social campesino. Las instituciones de las fuerzas armadas y de la policía nacional cubren al 0.83% y 0.81% de la población que corresponden a las fuerzas del orden público en servicio activo, pasivo y a sus dependientes. Mientras que, la red privada complementaria cubre al 9.92% de la población. Además, en el país existen cerca de 10 000 consultorios médicos particulares, en general dotados de infraestructura y tecnología elementales, ubicados en las principales ciudades y en los que la población suele hacer pagos directos de bolsillo en el momento de recibir la atención.
El país cuenta con un Listado de Medicamentos Esenciales llamado Cuadro Nacional de Medicamentos Básico (CNMB) actualizado y acorde a las recomendaciones de la OMS. Existe una exigencia legislativa para que los medicamentos seleccionados para la LME deban ser incluidos entre aquellos con cobertura garantizada en los conjuntos de prestaciones.
 El Salvador
El Salvador El Ministerio de Salud es el ente rector del sistema de salud y el mayor proveedor de servicios de salud. Su organización interna y sus servicios e instalaciones están estructurados técnica y administrativamente en un nivel central, cinco regiones de salud y 17 sistemas básicos de salud integral. El Instituto Salvadoreño del Seguro Social (ISSS) es la segunda institución con mayor cantidad de centros y cobertura poblacional; sus servicios de salud están estructurados en cuatro regiones. Las otras instituciones que conforman el Sistema Nacional de Salud son el Instituto Salvadoreño de Rehabilitación Integral (ISRI), el Instituto Salvadoreño de Bienestar Magisterial (ISBM), el Fondo Solidario para la Salud (FOSALUD), el Comando de Sanidad Militar (COSAM) y la Dirección Nacional de Medicamentos. El Ministerio de Salud es el responsable de la cobertura de 72,0% de los salvadoreños; el ISSS se ocupa de 25,1%; y el ISBM y el COSAM atienden a 1,6% y 1,1%, respectivamente.
No existe en el país un listado público de los medicamentos y otras tecnologías incorporadas, incluyendo las razones que llevaron a esa decisión. Solamente para el caso de los medicamentos, la ley de medicamentos en su Art. 16. Mandata que: “En coordinación con el Ministerio de Salud, la Dirección establecerá el Listado Oficial de Medicamentos de obligatoria existencia en el Sistema Nacional de Salud; dicho listado se publicará en el Diario Oficial.”
El país cuenta con un Listado de Medicamentos Esenciales (LIME) acorde a las recomendaciones de la OMS y actualizado, y existe una exigencia legislativa para que los medicamentos seleccionados para la LIME deban ser incluidos entre aquellos con cobertura garantizada en los conjuntos de prestaciones.
 Guatemala
Guatemala El ente rector nacional es el Ministerio de Salud Pública y Asistencia Social. Cuenta con una cobertura asignada de 70% y presta servicios en los tres niveles de atención; sin embargo, los indicadores de acceso son bajos, principalmente para la población indígena. El Instituto Guatemalteco de Seguridad Social cubre aproximadamente a 18% de la población y cerca de 8% de la población tiene acceso a seguros privados. El Ministerio de Salud Pública y Asistencia Social ha lanzado el Modelo Incluyente de Salud (MIS) como mecanismo para reordenar y fortalecer la red de servicios públicos de la salud. En el 2015, el Ministerio de Salud contaba con un modelo de atención en el primer nivel. Consiste en un proceso de institucionalización de los servicios de salud orientado a garantizar las acciones preventivas y de promoción a nivel individual, familiar y comunitario.
No existe en el país un listado público de los medicamentos y otras tecnologías incorporadas, incluyendo las razones que llevaron a esa decisión, solamente para el caso de los medicamentos.
Existe en el país un Manual de Normas de Atención Integral para primer y segundo nivel (2010) que tiene como objetivo proporcionar a los proveedores de salud los estándares básicos en las prestaciones que brindan y que es de uso obligatorio para el sector público.
El país cuenta con un Listado de Medicamentos Esenciales (LME) acorde a las recomendaciones de la OMS y actualizado, aunque no existe una exigencia legislativa para que los medicamentos seleccionados para la LME deban ser incluidos entre aquellos con cobertura garantizada en los conjuntos de prestaciones del resto de los subsectores de salud.
 México
México La Secretaría de Salud es la entidad responsable de establecer y conducir la política nacional en materia de asistencia social, servicios médicos y salud pública, a través del Consejo de Salubridad General. El sector público cuenta con distintas instituciones de seguridad social, como el Instituto Mexicano de Seguridad Social (IMSS), el Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE), Petróleos Mexicanos, la Secretaría de la Defensa Nacional y la Secretaría de Marina, este conjunto presta servicios a los trabajadores del sector formal de la economía. El Instituto de Salud para el Bienestar (INSABI) fue creado mediante Decreto el 29 de noviembre de 2019, es el responsable de organizar, operar y supervisar la prestación gratuita de servicios de salud, medicamentos y demás insumos asociados a las personas sin seguridad social, en coordinación con los Servicios Estatales de Salud y el Programa IMSS-BIENESTAR. El sector privado presta servicios a la población con capacidad de pago.
Dadas las características del sistema de salud de México, los esquemas de financiamiento son diferentes para las instituciones de seguridad social, así mismo, sus esquemas de cobertura son específicos para las intervenciones definidas por cada institución.
El esquema de financiamiento del INSABI, es federal y tiene como objetivo, asegurar un abasto suficiente de medicamentos, material de curación y equipos médicos en los establecimientos de salud, que atienda las demandas de las personas, los programas prioritarios y la morbilidad de cada territorio. Para cumplir este objetivo se ha impulsado la creación de un Compendio Nacional de Insumos de Salud emitido por el CSG, que racionaliza las claves de la compra pública evitando las duplicidades y adquisiciones de insumos obsoletos.
El Compendio Nacional de Insumos para la Salud (CNIS), sustituye al Cuadro Básico y Catálogo de Insumos del Sector Salud, es el documento en el que se agrupan, caracterizan y codifican todos los medicamentos, material de curación, auxiliares de diagnóstico, osteosíntesis y endoprótesis, instrumental y equipo médico, nutriología, herbolarios y homeopáticos empleados por las instituciones públicas del Sistema Nacional de Salud, con la finalidad de garantizar la equidad en el acceso a medicamentos y tener mayor cobertura en la atención (Aguilar-Delfín, et al, 2021).
El CNIS es una herramienta que se actualiza bajo estrictos criterios que analizan la eficacia, calidad, seguridad y costo-efectividad de los insumos que se incluyen y que se encuentran establecidos en el reglamento de la Comisión vigente. Si bien el país cuenta con un listado público y accesible de medicamentos y otras tecnologías incorporadas, este no incluye las razones que llevaron a esta decisión. El Compendio Nacional de Insumos y sus actualizaciones se encuentran disponibles en: http://www.csg.gob.mx/contenidos/priorizacion/cuadro-basico.html
Medicamentos: https://dof.gob.mx/nota_detalle.php?codigo=5616775&fecha=26/04/2021
Material de curación: https://dof.gob.mx/nota_detalle.php?codigo=5616521&fecha=22/04/2021
Auxiliares de diagnóstico: https://dof.gob.mx/nota_detalle.php?codigo=5547975&fecha=11/01/2019,
https://dof.gob.mx/nota_detalle.php?codigo=5547989&fecha=11/01/2019, https://dof.gob.mx/nota_detalle.php?codigo=5547987&fecha=11/01/2019.
Osteosíntesis y endoprótesis: https://dof.gob.mx/nota_detalle.php?codigo=5625473&fecha=02/08/2021
Equipo médico (Volumen II): https://www.dof.gob.mx/2021/CSG/CSG_280621.pdf
Nutriología: https://dof.gob.mx/2021/CSG/CSG_041021.pdf
 Paraguay
Paraguay El Sistema Nacional de Salud está integrado por los sectores público, privado y mixto. Presenta diversas modalidades de financiamiento, regulación, afiliación y provisión de servicios. La autoridad sanitaria la ejerce el Ministerio de Salud Pública y Bienestar Social (MSPyBS). El sector público está constituido por el Ministerio de Salud Pública y Bienestar Social, las sanidades militar, policial y de la Armada, el Instituto de Previsión Social (IPS), el Hospital de Clínicas y el Centro Materno Infantil. El sector privado cuenta con entidades sin fines de lucro y otras lucrativas. El Ministerio y el IPS son las instituciones de atención sanitaria que cubren 95% de la población. El gasto corriente total en salud en el año 2014 era de 7,7%, del PIB, 54,3% del cual correspondía al sector público y 45,7%, al privado.
Ley N° 5099 de 2013 establece la gratuidad de aranceles; en servicios de promoción de salud, prevención, diagnóstico, tratamiento y rehabilitación de enfermedades en los establecimientos dependientes del MSPyBS.
 Perú
Perú El Perú cuenta con un sistema de atención sanitaria descentralizado, administrado por cinco entidades: el Ministerio de Salud (MINSA), que ofrece servicios de salud para el 60% de la población; EsSalud-Seguridad Social, que cubre el 30% de la población; y las Fuerzas Armadas (FFAA), la Policía Nacional (PNP), y el sector privado, que proporcionan servicios sanitarios al 10% restante. El resultado es un sistema mixto muy fragmentado, con participación pública y privada de prestadores. El ente rector es el Ministerio de Salud. El sector público presta servicios de salud en dos formas: en el régimen subsidiado o contributivo indirecto, y en el contributivo directo, que es el que corresponde a la seguridad social (EsSalud). El Seguro Integral de Salud (SIS) presta atención de salud a toda persona que se encuentre en suelo peruano y no cuente con otro seguro de salud público o privado.
Por lo tanto, todos los habitantes del Perú acceden a algún seguro de salud auspiciado por los poderes públicos, con una protección en salud básica garantizada para quienes no poseen capacidad contributiva. El aseguramiento se genera ya sea por la vía contributiva (personas con capacidad contributiva) o por la vía no contributiva.
A partir del Decreto Supremo 004-2007-SA se estableció el Listado Priorizado de Intervenciones Sanitarias de aplicación obligatoria para todos los establecimientos que reciban financiamiento del Seguro Integral de Salud-SIS. Ese Listado por Decreto supremo 007-2012-SA fue sustituido por el Plan Esencial de Aseguramiento en Salud (PEAS) . El PEAS es el conjunto de prestaciones que corresponde a la cobertura de salud que como mínimo todas las instituciones aseguradoras y proveedoras de salud, tanto públicas como privadas, están en obligación de financiar y proveer. En la actualidad hay un proyecto para la actualización del PEAS. Para mayor información: https://cdn.www.gob.pe/uploads/document/file/1493555/Listado%20PEAS%20%28Parte%201%29.pdf
El país cuenta con un Listado de Medicamentos Esenciales (LME) llamado Petitorio Nacional Único de Medicamentos Esenciales – PNUME – acorde a las recomendaciones de la OMS y actualizado actualizado al 2018 y forma parte del PEAS. Existe una exigencia legislativa para que los medicamentos seleccionados para el LME deban ser incluidos entre aquellos con cobertura garantizada en los conjuntos de prestaciones. El Petitorio Nacional Único de Medicamentos Esenciales (PNUME) aprobado por Resolución Ministerial N° 1361-2018/MINSA y su modificatoria reemplaza al listado aprobado en Julio de 2015 y consta de 782 medicamentos contenidos en 32 grupos farmacoterapéuticos.
 República Dominicana
República Dominicana El Ministerio de Salud Pública tiene las funciones de rectoría e incluye el Servicio Nacional de Salud. En el 2015, 65% de la población estaba adscrita al Seguro Familiar de Salud. De este grupo, 47,5% tenía régimen subsidiado y 52,5%, régimen contributivo. El Servicio Nacional de Salud dispone de 1 450 centros de primer nivel de atención, de 1 774 unidades de atención primaria (UNAP) y de 189 centros especializados de atención a la salud (CEAS), entre los que se encuentran 13 hospitales regionales, 35 hospitales provinciales, 122 hospitales municipales y 19 hospitales de referencia. Estos establecimientos procuran contar con la capacidad necesaria para prestar las atenciones indicadas en el Plan Básico de Salud (PBS), que incluye un conjunto de servicios otorgados a través del Seguro Familiar de Salud a las personas afiliadas al Régimen Contributivo del Sistema Dominicano de Seguridad Social (SDSS). El mismo fue creado por la Ley 87-01 del 2001.
El país no cuenta con un listado público las tecnologías de salud incorporadas, incluyendo las razones que llevaron a esta decisión.
El país no cuenta con un listado público de los medicamentos y otras tecnologías incorporadas, incluyendo las razones que llevaron a esta decisión.
El país cuenta con un Listado de Medicamentos Esenciales actualizado (LME) llamado Cuadro Básico de Medicamentos (CBME), acorde a las recomendaciones de la OMS que se actualiza cada dos años y cuyos medicamentos deben ser incluidos entre aquellos con cobertura garantizada en el conjunto de prestaciones del país.
 Uruguay
Uruguay El Ministerio de Salud Pública mantiene sus competencias indelegables en la rectoría sobre la conducción, las funciones esenciales de salud pública, la regulación, la habilitación y la acreditación de servicios y profesionales de salud. La Dirección General de la Salud coordina y controla las políticas públicas sanitarias. La Dirección General de Secretaría asume los aspectos administrativos, financieros y de gestión de los recursos humanos. La Junta Nacional de Salud (JUNASA) administra el seguro nacional de salud; la Dirección General de Coordinación articula la integración pública y privada, y el Fondo Nacional de Salud (FONASA, fondo público obligatorio) financia al sistema de salud. El Artículo 45º de la Ley Nº 18.211 del 5 de diciembre de 2007 establece que las entidades públicas y privadas que integren el Sistema Nacional Integrado de Salud (SNIS) deben suministrar a la población usuaria los programas integrales de prestaciones que apruebe el Ministerio de Salud Pública, a través del PIAS. Este catálogo, contiene el listado de prestaciones con cobertura universal del SNIS así como el listado de Medicamentos Esenciales (LME), denominado Formulario Terapéutico de Medicamentos (FTM) acorde a las recomendaciones de la OMS. El FTM se somete a revisión periódica a cargo de la Comisión de Actualización del Formulario Terapéutico de Medicamentos, entidad que tiene como principal función proponer cada dos años al Ministerio de Salud la nómina actualizada de medicamentos al FTM.
Desde la creación del Sistema Nacional Integrado de Salud (SNIS) existen dos fondos públicos para financiar las prestaciones de atención médica: el FONASA y el FNR, los cuales reciben el aporte mensual proveniente de Rentas Generales, correspondiente al descuento de los haberes del usuario con actividad laboral formal o jubilados, como contraprestación de su inclusión al sistema de salud.
Los Prestadores Integrales reciben del FONASA una cápita mensual ajustada por edad, sexo y cumplimiento de las metas asistenciales. El FNR por cada socio FONASA o particular, se vuelca en los IMAE o laboratorios como contraprestación o adquisición de medicamentos u otras tecnologías.
La solicitud de incorporación de cualquier tecnología nueva bajo la cobertura universal se realiza a través del Ministerio de Salud Pública. La solicitud puede partir del propio MSP (necesidad sanitaria), del cuerpo médico (Sociedades Científicas), de la Universidad (Facultades de Medicina, de Odontología, de Psicología, de Enfermería, Nutrición), de los Prestadores Integrales, de las Asociaciones de Pacientes, de la Industria ya sea de Medicamentos u otras, entre otros.
De acuerdo con la normativa vigente, la evaluación de una potencial incorporación a la cobertura del FNR, se estudia por una Comisión que funciona en la órbita del MSP, la cual está integrada por representantes del MSP, de la Facultad de Medicina, del FNR y del cuerpo médico nacional. Según el criterio de representatividad del cuerpo médico establecido en la norma, el Sindicato Médico del Uruguay (SMU) y la Federación Médica del Interior (FEMI) son quienes proponen integrantes para la Comisión Técnica Asesora (CTA).
La normativa uruguaya, establece la necesidad de contar con un informe de impacto presupuestal del FNR, definiendo a cuánto debería ascender la cuota que recibe el FNR para poder financiar la nueva prestación; este informe forma parte del presupuesto anual y asimismo, se proyecta el gasto a 5 años para resolver un incremento de cuota extraordinaria, fuera de las establecidas en el presupuesto anual. En la medida en que el incremento sea económicamente sustentable, se aprueba la incorporación, se elabora la normativa de cobertura financiera de la prestación, basada en evidencia médica y en la revisión de la literatura científica, donde quedan establecidos los criterios de inclusión de los casos que son plausibles de recibir el tratamiento. Una vez que la Comisión Honoraria Administradora del FNR y el MSP aprueban la incorporación bajo la cobertura, la TS queda disponible para su indicación por los médicos tratantes.
El país cuenta con un Listado de Medicamentos Esenciales (LME) – llamado Formulario Terapéutico de Medicamentos – acorde a las recomendaciones de la OMS y actualizado, y existe una exigencia legislativa para que los medicamentos seleccionados para la LME deban ser incluidos entre aquellos con cobertura garantizada en los conjuntos de prestaciones.
 Argentina
Argentina Existen en el país mecanismos de desinversión para las TS, sin embargo, no existe aún un proceso explícito para llevar a cabo este proceso.
Un ejemplo claro de desinversión fue el implementado dentro del subsistema de salud de las obras sociales, por el Instituto Nacional de Jubilados y Pensionados (PAMI) sacando de su cobertura los tratamientos combinados de glucosaminoglicanos/AINEs.
 Brasil
Brasil Existen en el país mecanismos formales de desinversión para las TS.
El proceso formal de desinversión de tecnología sigue el mismo procedimiento para la inclusión. Sin embargo, existen situaciones específicas en que el propio Ministerio de Salud realiza la solicitud de desinversión, por ejemplo, cuando un dispositivo o medicamento tiene su autorización de comercialización cancelada por Anvisa. En estos casos, la evaluación se realiza de manera simplificada, presentándose al Pleno las razones de la indisponibilidad del fármaco en el mercado brasileño y si ya existe otra tecnología disponible en el SUS para reemplazarlo, y no es necesario preparar un informe completo de ETS.
 Chile
Chile No existen en el país mecanismos formales de desinversión para las TS.
 Costa Rica
Costa Rica No existen en el país mecanismos formales de desinversión para las TS.
 Ecuador
Ecuador No existen en el país mecanismos formales de desinversión para las Tecnologías Sanitarias.
 El Salvador
El Salvador Existen en el país mecanismos de desinversión para las TS. Son ejemplos la exclusión de los listados oficiales los siguientes medicamentos: Ácido fólico + Sulfato ferroso en tabletas, Kanamicina 1g, Ranitidina en tabletas.
 Guatemala
Guatemala No existen en el país mecanismos oficiales de desinversión para las TS.
 México
México Dentro del proceso de actualización del CNIS, se define la exclusión, como la desincorporación fundamentada de un insumo de alguna o todas sus presentaciones y especificaciones del Compendio.
El artículo 32 del Reglamento de la Comisión establece que:
“Toda solicitud de exclusión, independientemente del tipo de insumo de que se trate, deberá contener los datos de contacto de la persona responsable e incluir una justificación desde el punto de vista clínico, epidemiológico, farmacológico, económico y/o tecnológico que considere:
Cuando se solicite la exclusión de un insumo, la solicitud será publicada en la página de Internet del Consejo 60 días previos al dictamen, con el objeto de conocer opiniones al respecto de las Instituciones de Sector Salud. La publicación de exclusiones en respuesta a alertas nacionales o internacionales de eventos adversos graves ocasionados por el insumo se hará en el momento en que se considere necesario.
 Paraguay
Paraguay No existen en el país mecanismos formales de desinversión para las TS incorporadas previamente en el paquete de beneficios.
 Perú
Perú Existen en el país procesos de inversión utilizados en el Petitorio Nacional Único de Medicamentos Esenciales – PNUME.
En el sub sector de EsSalud, el IETSI como responsable de los petitorios institucionales es el encargado de retirar o modificar tecnologías sanitarias de los mencionados listados, por lo que sí realiza la desinversión de TS en nuestro sub-sector.
En la UFETS – INEN, se cuenta con un proceso de Evaluación y aprobación de continuidad de tecnologías sanitarias existentes. Este tiene como objetivo: Garantizar la continuidad de una tecnología sanitaria a nivel institucional cuando se encuentre nueva evidencia internacional o local que valide su seguridad, eficacia o eficiencia costo-efectividad.
 República Dominicana
República Dominicana No existen en el país mecanismos formales de desinversión para las TS incorporadas previamente en el paquete de beneficios.
 Uruguay
Uruguay No existe en el país un mecanismo oficial de desinversión para las TS, pero si para los Medicamentos incluidos en el Formulario Terapéutico de Medicamentos.
 Argentina
Argentina En el país no existe una estrategia o plan Nacional de Uso Racional de Medicamentos y otras Tecnologías de Salud.
La prescripción por nombre genérico o Denominación Común Internacional (DCI) es obligatoria en el sector público del país y en la dispensa está permitida la sustitución por medicamentos multifuentes. Más información en: http://www.anmat.gov.ar/fna/25649.asp
El Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA) creó en 2015 el Programa Nacional de Vigilancia de la Resistencia Antimicrobiana en animales destinados al consumo humano, con el objetivo de prevenir la generación y difusión de bacterias que resisten la acción de los antibióticos. En 2015 se aprueba a través de la Resolución Conjunta 834/2015 y 391/2015 del Ministerio de Salud y el ex Ministerio de Agricultura, Ganadería y Pesca, la «Estrategia Argentina para el Control de la Resistencia Antimicrobiana” y una Comisión Nacional de Control de la Resistencia Antimicrobiana (CoNaCRA) integrada por los distintos organismos públicos con responsabilidad en la materia. La Comisión tiene la responsabilidad de verificar el cumplimiento de la estrategia nacional para el control de la resistencia antimicrobiana tanto en animales como en humanos. Los ejes de trabajo para reducir el impacto de este fenómeno y limitar su propagación son: el fortalecimiento de la vigilancia clínica, microbiológica y farmacéutica, la regulación y fiscalización de la comercialización de antimicrobianos, la promoción del consumo racional y prudente, la detección precoz y el control de las infecciones en hospitales y en establecimientos agropecuarios, la promoción de la innovación en antimicrobianos. En el 2020 se creó además la Coordinación de Uso Apropiado de Antimicrobianos en el ámbito del Ministerio de Salud de la Nación con el fin de profundizar las acciones en favor de la lucha contra la RAM y en el uso adecuado de los antimicrobianos.
 Brasil
Brasil En el país existe una estrategia o plan Nacional de Uso Racional de Medicamentos, pero no del resto de las Tecnologías de Salud. El Plan de Uso Racional de Medicamentos es llevado a cabo por el Comité Nacional de Promoción de Uso Racional de Medicamentos (CNPURM), dependiente del Ministerio de Salud y constituido en junio de 2007 cuyo propósito es orientar y proponer acciones, estrategias y actividades para promover el uso racional de los medicamentos, considerando la Política Nacional de Promoción de la Salud republicada en el Anexo I de la Ordenanza Consolidada No.2/GM/MS, de 28 de septiembre de 2017.
Corresponde al CNPURM:
I. Identificar y proponer estrategias y mecanismos de articulación, seguimiento y evaluación orientados a promover el uso racional de los medicamentos, de acuerdo con los principios y lineamientos del SUS;
II. Proponer directrices y estrategias nacionales para promover el uso racional de medicamentos en consonancia con las políticas nacionales sobre medicamentos, asistencia farmacéutica y legislación relacionada;
III. Identificar y proponer estrategias que requieran la articulación entre organismos y entidades públicas y privadas, cuyas competencias estén relacionadas con la promoción del uso racional de los medicamentos;
IV. Contribuir, mediante la promoción del uso racional de los medicamentos, a la expansión y calificación del acceso a medicamentos de calidad, seguros y eficaces;
V. Proponer la mejora de los marcos regulatorios y de vigilancia de medicamentos y servicios farmacéuticos en el ámbito del Sistema Nacional de Vigilancia Sanitaria (SNVS);
VI. Proponer directrices y colaborar con la consolidación de las acciones de farmacovigilancia en el ámbito de la asistencia farmacéutica y el SNVS;
VII. Proponer el Plan de Formación de Profesionales de la Salud para el Uso Racional de Medicamentos;
VIII. Promover la integración y articulación entre organismos y entidades públicas y privadas del territorio nacional cuyas competencias estén relacionadas con la promoción del uso racional de los medicamentos;
IX. Proponer iniciativas de investigación y desarrollo científicas, tecnológicas y profesionales relacionadas con el uso racional de los medicamentos.
Para mayor información: https://antigo.saude.gov.br/saude-de-a-z/uso-racional-de-medicamentos
La prescripción por nombre genérico o Denominación Común Internacional (DCI) es obligatoria en el sector público del país y en la dispensa está permitida la sustitución por medicamentos multifuentes, de acuerdo a la Ley 9787 de febrero de 1999.
El país cuenta con una Estrategia Nacional definida y escrita para la contención de la resistencia a los antimicrobianos (RAM) llamado Plan Nacional de Acción para la Prevención y Control de la Resistencia a Antimicrobianos de Brasil (PAN-BR 2018-2022). El mismo se elaboró en convergencia con los objetivos definidos por la alianza tripartita entre la Organización Mundial de la Salud (OMS), la Organización de las Naciones Unidos por la Alimentación y la Agricultura (FAO) y la Organización Mundial de Sanidad Animal (OIE). El objetivo dl plan de acción es asegurar que se mantenga la capacidad para tratar y prevenir enfermedades infecciones con medicamentos seguros y eficaces de calidad asegurada y que se utilizan de forma responsable y accesible para todos los que los necesiten.
Para atender esta necesidad, el PAN-BR cuenta con la participación de varios actores: Ministerio de Salud (MS), Agencia Nacional de Vigilancia Sanitaria (Anvisa), Ministerio de Agricultura, Ganadería y Abastecimiento (Mapa), Ministerio de Ciudades (MCidades), Ministerio de Educación y Cultura (MEC), Ministerio de Ciencia, Tecnología, Innovaciones y Comunicaciones (MCTIC), Ministerio de Medio Ambiente Medio Ambiente (MMA), Fundación Nacional de Salud (Funasa), además del apoyo del Consejo Nacional de Salud (CNS) y la Agencia Nacional del Agua (ANA).
Para fortalecer las acciones del PAN-BR, se crearon estructuras de gobernanza en los órganos directamente involucrado con el tema, a través de comités específicos en las áreas del Ministerio de Salud (Cipan – Ordenanza No. 2.775, de 22 de diciembre de 2016), la Agencia Nacional de Vigilancia Sanitaria (CVSRM, Ordenanza No. 854, de 7 de abril de 2016) y el Ministerio de Agricultura, Ganadería y Abastecimiento (CPRA – Ordenanza SDA nº 45/2016).
El país no ha adoptado las buenas prácticas de prescripción (BPP) y las buenas prácticas de farmacia (BPF) de acuerdo con el documento de la FIP/OMS. No se utilizan indicadores para el monitoreo de alguna variable relacionada con las prácticas de prescripción y dispensación a nivel nacional.
 Chile
Chile En el país no existe una estrategia, plan o comité nacional de uso racional de medicamentos (URM) y otras tecnologías de salud general, pero si se cuenta con procesos definidos para la coordinación de acciones con otros actores y programas relacionados con tema específicos (programa de enfermedades crónicas, farmacovigilancia, control de uso de antibióticos, uso racional de medicamentos).
En relación al Uso Racional de Medicamentos (URM) el Ministerio de Salud, a través de diversas actividades ha decidido avanzar en la elaboración de directrices, guías y metodologías destinadas a la implementación de procesos sólidos, racionales y eficientes que permitan lograr el máximo beneficio de los medicamentos en los diversos niveles de su uso, colocando a disposición de los profesionales y la comunidad información de base, orientaciones y recomendaciones para el desarrollo de las actividades de cada nivel referentes al uso apropiado de medicamentos.
La prescripción por nombre genérico o Denominación Común Internacional (DCI) es obligatoria en el sector público del país y en la dispensa está permitida la sustitución por medicamentos multifuentes.
 Costa Rica
Costa Rica En el país no existe una estrategia o plan Nacional de Uso Racional de Medicamentos y otras Tecnologías de Salud o un comité encargado especialmente de la temática.
La prescripción por nombre genérico o Denominación Común Internacional (DCI) es obligatoria en el sector público del país y en la dispensa está permitida la sustitución por medicamentos multifuentes.
En el país existe una estrategia nacional contra la contención de la Resistencia Antimicrobiana (RAM): Plan Nacional de Lucha Contra la Resistencia a los Antimicrobianos 2018-2025. Se sustenta en la Ley General de Salud y el Decreto Nº 40556-S Reglamento del Sistema Nacional de Vigilancia de la Salud, Ley General del Servicio Nacional de Salud Animal 8495, la Ley de Protección Fitosanitario 7664 y el Reglamento a la Ley 26921-MAG. Legislación referente a las responsabilidades por parte de las instituciones gubernamentales y la comunidad de forma integrada en los componentes de vigilancia, atención médica y promoción.
 Ecuador
Ecuador En el país no existe una estrategia o plan Nacional de Uso Racional de Tecnologías de Salud, pero hay intenciones de desarrollarlo. Tampoco se cuenta una estructura nacional o comité que coordine estas temáticas desde el ministerio de salud.
La “Ley Orgánica de Salud” (https://www.salud.gob.ec/wp-content/uploads/2017/03/LEY-ORGÁNICA-DE-SALUD4.pdf), Art. 154, establece que el Estado garantizará el acceso y disponibilidad de medicamentos de calidad y su uso racional, priorizando los intereses de la salud pública sobre los económicos y comerciales. Además, en la “Ley de Producción, Importación, Comercialización y Expendio de Medicamentos Genéricos de Uso Humano”, Art. 6, menciona que las entidades del sector público que tengan a su cargo prestaciones y programas de salud están obligadas a adquirir exclusivamente medicamentos genéricos, con las siguientes excepciones, incluyendo: 1) cuando el medicamento de marca de similar calidad, se ofrezca a menor precio que el medicamento genérico; 2) En caso de emergencia sanitaria debidamente declarada por el Ministro de Salud Pública, y/o las razones de fuerza mayor que no permitan conseguir el respectivo medicamento genérico, entre otras.
La Política Nacional de Medicamentos 2017 – 2021 (https://www.registroficial.gob.ec/index.php/registro-oficial-web/publicaciones/ediciones-especiales/item/9018-edición-especial-no-969) incluye entre sus lineamientos estratégicos la Optimización del uso adecuado de los medicamentos por parte de los tomadores de decisión, profesionales de la salud y usuarios, a través de las siguientes líneas de acción, entre otros:
– Monitoreo y evaluación continua del uso y consumo de medicamentos en los servicios de salud como indicador de calidad de la prestación del servicio de salud.
– Generación de fuentes de información y educación profesional continua independiente y de calidad que contribuyan a disminuir el riesgo de error profesional inherente al uso de medicamentos.
– Fortalecimiento del ámbito de la evaluación de la eficacia, seguridad y costo efectividad de los medicamentos, incluyendo la Evaluación de Tecnologías Sanitarias (ETS), con el fin de producir información independiente, oportuna y de calidad para una mejor toma de decisiones en los procesos de registro sanitario, selección de medicamentos esenciales, fijación del precio de medicamentos y otros relacionados.
-Promover el uso adecuado de medicamentos de alto impacto financiero, incluyendo medicamentos para enfermedades catastróficas y raras.
Adicionalmente en el país, la Agencia de Aseguramiento de la Calidad de los Servicios de Salud y Medicina Prepagada (ACESS) a través de Resolución No. ACESS-2021-0006 emitió “La normativa técnica para el control de la prescripción de medicamentos de uso y consumo humano, y de la emisión de la receta médica.” (http://www.calidadsalud.gob.ec/wp-content/uploads/2021/02/normativa_tecnica_am_0031-2020.pdf) con el objetivo de establecer los criterios técnicos para el control de la prescripción de medicamentos de uso y consumo humano; así como, el control de la emisión de la receta médica en los establecimientos de salud del Sistema Nacional de Salud, dentro del cual se incluye la aplicación de Buenas Prácticas de Prescripción concebida como un conjunto de acciones que aplicadas de manera secuencial permiten alcanzar una prescripción racional de medicamentos.
Por su parte, la ARCSA publica la guía externa “Buenas Prácticas de Farmacia y Dispensación para Farmacias y Botiquines” (https://www.controlsanitario.gob.ec/wp-content/uploads/downloads/2019/07/Anexo2_GE-D.2.2-EST-02_V.3.0_Guia_BPFD_consulta_publica.pdf) con el objetivo de facilitar a los usuarios aplicar Buenas Prácticas de Recepción, Almacenamiento y Dispensación de medicamentos en farmacias y botiquines a nivel nacional, con la finalidad de garantizar el acceso a medicamentos mediante una correcta y efectiva dispensación en beneficio de la salud de la población.
La prescripción por nombre genérico o Denominación Común Internacional (DCI) es obligatoria en el sector público del país y en la dispensa está permitida la sustitución por medicamentos multifuentes.
En el país no existe una estrategia nacional para la contención de la resistencia a los antimicrobianos que incluya un plan de medición de resultados.
 El Salvador
El Salvador En el 2015, se conforma la Comisión Nacional para el Uso Racional de Medicamentos y otras Tecnologías Sanitarias (CONAMED), que esta integrado por un representante de cada una de las siguientes instituciones: Ministerio de Salud, Dirección Nacional de Medicamentos, Instituto Salvadoreño del Seguro Social, Instituto Salvadoreño de Bienestar Magisterial, Instituto Salvadoreño de Rehabilitación Integral, Comando de Sanidad Militar, Fondo Solidario para la Salud, Consejo Superior de Salud Pública, Instituto Nacional de Salud, Defensoría del Consumidor, Facultad de Medicina y Facultad de Química y Farmacia, ambas de la Universidad de El Salvador, Comisión de Salud de la Asamblea Legislativa, Corte Suprema de Justicia, Colegio Médico, Colegio de Químicos y Farmacéuticos y Foro Nacional de Salud. En la actualidad, como se describió en la dimensión de Configuración institucional y gobernanza, en la Dirección de Tecnologías Sanitarias, existe la Unidad de Uso Racional de Tecnologías Sanitarias.
En el país existe una estrategia Nacional de Uso Racional de Medicamentos y otras Tecnologías de Salud autorizada por Resolución Ministerial de Salud Nº 256, de noviembre de 2017: “Plan nacional para la promoción del acceso y el uso racional de medicamentos y otras tecnologías sanitarias”
La prescripción por nombre genérico o Denominación Común Internacional (DCI) es obligatoria en el sector público del país y en la dispensa está permitida la sustitución por medicamentos multifuentes. Para mayor información: http://asp.salud.gob.sv/regulacion/pdf/ley/ley_de_medicamentos_.pdf
El país cuenta con una Estrategia nacional escrita para la contención de la resistencia a los antimicrobianos. En 2015 se publicaron los Lineamientos técnicos para la prevención, vigilancia y contención de resistencia bacteriana a los antimicrobianos (2015), cuyo objetivo es establecer los lineamientos que el personal de salud debe cumplir para la prevención, vigilancia y contención de la resistencia bacteriana a los antimicrobianos en las Redes Integrales e Integradas de Servicios de Salud (RIISS), para contribuir al control de la resistencia de los principales agentes bacterianos de importancia en salud.
 Guatemala
Guatemala En el país existe una estrategia Nacional de Uso Racional de Medicamentos aprobada por Norma Técnica 181-2019: “Normativa para la Regulación de Medicamentos de prescripción médica, antimicrobianos y esteroides oftálmicos”, pero no incluye otras Tecnologías sanitarias. Esta estrategia incluye la contención de la resistencia a los antimicrobianos.
La prescripción por nombre genérico o Denominación Común Internacional (DCI) es obligatoria en el sector público del país y en la dispensa está permitida la sustitución por medicamentos multifuentes.
 México
México En México se han realizado esfuerzos en materia del uso racional de medicamentos, y en la conformación de una Política Nacional de Medicamentos, sin embargo, no se ha consolidado.
En la modificación a la Ley General de Salud publicada el 29 de noviembre de 2019 en el Diario Oficial de la Federación, se adiciona el artículo 226 Bis en donde se establece que la Secretaría de Salud debe expedir los “Lineamientos del Sistema de Distribución de Medicamentos en Dosis Unitarias”. Este sistema está dirigido a la atención intrahospitalaria de las instituciones públicas para garantizar que el medicamento prescrito llegue al paciente con un mejor control y seguimiento del tratamiento, racionalizando la distribución y el uso de los medicamentos, disminuyendo el costo hospitalario asociado a la medicación al minimizar el tamaño de los inventarios de medicamentos en los servicios y disminuyendo las mermas por pérdidas, deterioro o vencimiento.
Se cuenta con una Estrategia Nacional de Acción contra la Resistencia a los Antimicrobianos (RAM) a nivel nacional de obligatorio cumplimiento con el fin de que en el país se haga un uso racional de antimicrobianos para la salud humana, salud animal y en los cultivos con el objeto de reducir la diseminación de la RAM en los diferentes sectores de salud pública, agricultura y medio ambiente.
 Paraguay
Paraguay En el país no existe una estrategia o plan Nacional de Uso Racional de Medicamentos y otras Tecnologías de Salud ni tampoco un comité que lidere la temática a nivel nacional pero están interesados en desarrollar el área.
La prescripción por nombre genérico o Denominación Común Internacional (DCI) no es obligatoria en el sector público del país y en la dispensa no está permitida la sustitución por medicamentos multifuentes, pero es de interés.
El país no ha adoptado formalmente las buenas prácticas de prescripción (BPP) o las buenas prácticas de farmacia (BPF) de acuerdo a los documentos de la FIP y OMS.
El país no cuenta con una estrategia nacional para la contención de la resistencia a los antimicrobianos que incluya un plan de medición de resultados y/o una estructura nacional dedicada a producir informes y recomendaciones para la promoción del uso apropiado de los antimicrobianos y para la prevención de la propagación de las infecciones. Es de interés avanzar en ello.
 Perú
Perú En el país no existe una estrategia o plan Nacional de Uso Racional de Medicamentos y otras Tecnologías de Salud ni un comité que lidere la temática en el país, pero si están interesados en desarrollar el área para 2025.
La prescripción por nombre genérico o Denominación Común Internacional (DCI) es obligatoria en el sector público del país y en la dispensa no está permitida la sustitución por medicamentos multifuentes. Para mayor información: https://infopublic.bpaprocorp.com/banco-de-leyes/ley-29459
El país cuenta con un Plan Nacional para enfrentar la resistencia a los antimicrobianos 2017-2021. El plan sigue los lineamientos establecidos en el Plan de Acción Mundial para enfrentar la resistencia antimicrobiana, documento aprobado por la Asamblea Mundial de la Salud, el cual se basa en cinco objetivos estratégicos: Mejorar la concienciación y la comprensión con respecto a la resistencia a los antimicrobianos a través de una comunicación, educación y formación efectivas; Reforzar los conocimientos y la base científica a través de la vigilancia y la investigación; Reducir la incidencia de las infecciones con medidas eficaces de saneamiento, higiene y prevención de la infección; Utilizar de forma óptima los medicamentos antimicrobianos en la salud humana y animal; Preparar argumentos económicos a favor de una inversión sostenible que tenga en cuenta las necesidades de todos los países, y aumentar la inversión en nuevos medicamentos, medios de diagnóstico, vacunas y otras intervenciones.
Además, mediante Decreto Supremo Nª 010-2019-SA, y con fecha de 17 de mayo del presente año, se aprobó el Plan Multisectorial para enfrentar la Resistencia a los antimicrobianos 2019-2021 y se crea la Comisión Multisectorial de Naturaleza Permanente para su seguimiento e implementación. La finalidad del plan es disminuir el riesgo sanitario que implica la resistencia a los antimicrobianos en el país. El Plan es de alcance nacional en instituciones públicas y privadas, cuyas competencias estén relacionadas con las actividades señaladas.
 República Dominicana
República Dominicana En el país no existe una estrategia o plan Nacional de Uso Racional de Medicamentos y otras Tecnologías de Salud ni tampoco un comité que lidere la temática a nivel nacional pero están interesados en desarrollar el área.
La prescripción por nombre genérico o Denominación Común Internacional (DCI) es obligatoria en el sector público del país y en la dispensa no está permitida la sustitución por medicamentos multifuentes.
El país no cuenta con una estrategia nacional para la contención de la resistencia a los antimicrobianos (RAM) que incluya un plan de medición de resultados. Tampoco cuenta al momento con una estructura nacional dedicada a producir informes y recomendaciones para la promoción del uso apropiado de los antimicrobianos y para la prevención de la propagación de las infecciones que tiene como finalidad también elaborar una estrategia nacional para la contención de la resistencia a los antimicrobianos que incluya un plan de medición de resultados, pero aún no está publicada y vigente.
 Uruguay
Uruguay En el país no existe una estrategia o Plan Nacional para el Uso Racional de Medicamentos y otras Tecnologías de Salud como así tampoco un comité o área que se desarrolle específicamente en la temática. Sin embargo, para los medicamentos de alto costo cubiertos por el FNR existen normativas con criterios claros de exclusión e inclusión, y requisitos de control. Aunque las normativas no son Guías de Práctica Clínica, son elaboradas por expertos en la patología tanto nacionales e internacionales y sometidas a auditoría por organismos externos.
La prescripción por nombre genérico o Denominación Común Internacional (DCI) no tiene carácter obligatorio para el sector público y en la dispensa no está permitida la sustitución por medicamentos multifuentes. Sin embargo, el Decreto 321/003 de fecha 13 de agosto de 2003, establece que las Instituciones de Asistencia Médica Colectiva y las Instituciones de Asistencia Médica Particular, deben brindar a sus asociados, afiliados, usuarios o contratantes un Listado de Medicamentos por Denominación Genérica del principio activo o Denominación Común Internacional.
En el país existe desde 2018 un Plan Nacional de Acción contra la Resistencia Antimicrobiana para la contención de la resistencia a los antimicrobianos (RAM); éste, además, se refuerza con la exigencia de la presentación de receta médica para la dispensación en farmacias comunitarias. Por otra parte, en el año 2022, el Ministerio de Salud Pública desde la Dirección General de la Salud (División Epidemiología del Área de Vigilancia en Salud de la Población), ha emitido un documento “Recomendaciones para la constitución y funcionamiento de los Programas de Optimización de Antimicrobianos en los prestadores del Sistema Nacional Integrado de Salud” (PROA), con el objetivo de brindar los lineamientos para su desarrollo e implementación en el marco de la vigilancia de las infecciones asociadas a la atención en centros de salud.
En el país no se han adoptado formalmente directrices para las Buenas Prácticas de prescripción (BPP) o para las Buenas Prácticas de Farmacia (BPF) de acuerdo con la FIP/OMS, sin embargo, estos temas se vienen trabajando por parte de grupos técnicos desde la Asociación de Química y Farmacia del Uruguay.
 Argentina
Argentina Existen diferentes estructuras que desarrollan las guías a nivel nacional con estructuras funcionales propias e independientes. Por ejemplo, dentro del Ministerio de Salud hay varias áreas que elaboran guías (ej.: Enfermedades Crónicas, Calidad de Atención Médica) como así también otros organismos descentralizados (ej.: Superintendencia de Servicios de Salud), así como las actividades en sentido similar generadas por Sociedades Científicas independientes y también las GPC elaboradas por los ministerios de salud provinciales.
El país cuenta con una normativa nacional y guía para la elaboración y adaptación de GPC disponible en: https://www.boletinoficial.gob.ar/detalleAviso/primera/218567/20191010?busqueda=1, pero no cuenta con una estrategia o política nacional para establecer mecanismos que faciliten la implementación de las GPC en los diferentes niveles. Tampoco se cuenta con un plan para actualizar las GPC que así lo requieran o evaluaciones de resultados de la implementación y utilización de las GPC. Las guías se elaboran informadas por la evidencia y desde el Ministerio de Salud nacional se enfoca en favorecer y fortalecer la metodología GRADE. Se han desarrollado varias guías utilizando esta metodología pero hace falta mayor institucionalización.
En la priorización para la elaboración de las GPC y en su propia elaboración, no se suele tener en cuenta los informes de ETS, por lo tanto no existe una concordancia en todos los casos. Sin embargo, una vez que una TS es incorporada al PMO se pretende monitorear su indicación en las GPC y su correspondencia con las especificaciones de incorporación establecidas (edad de pacientes, estadio de patología, cumplimiento de criterios diagnósticos, tratamientos previos, etc.).
La CONETEC en 2023 ha publicado su primer GPC basada en evidencia (“GPC Para el tratamiento con potenciadores y moduladores del Regulador de la Conductancia Transmembrana de la Fibrosis Quística”).
Enlaces para búsqueda de GPC del país:
https://www.argentina.gob.ar/salud/calidadatencionmedica/guiaspracticaclinica ; https://bancos.salud.gob.ar/bancos/materiales-para-equipos-de-salud ; https://www.argentina.gob.ar/salud/conetec/guias-de-practica-clinica
 Brasil
Brasil La Comisión Nacional de Incorporación de Tecnologías – Conitec, es responsable de la constitución y actualización de las Guías de Práctica Clínica (PCDT) que serán utilizadas dentro del Sistema Único de Salud – SUS. El Departamento de Gestión e Incorporación de Tecnologías Sanitarias (DGITS) del Ministerio de Salud coordina todo el proceso de elaboración de estas Guías además de definir la metodología, así como la Secretaría Ejecutiva del Conitec.
El país cuenta con una normativa nacional y Guía para la elaboración y adaptación de GPC (2016) pero no cuenta con una estrategia o política nacional para establecer mecanismos que faciliten la implementación de las GPC en los diferentes niveles o evaluaciones de resultados de la implementación y utilización de las GPC. Para el caso de los medicamentos, existe un sistema de monitoreo del impacto de la implementación de las GPC en los indicadores del sistema de salud por medio del control de dispensación. La guía metodológica establece los criterios de elaboración, adaptación, difusión e implementación de las GPC. Establece entre otros, la necesidad de declaración de conflicto de interés de los participantes de la misma y la revisión externa o consulta pública y la constitución de un plan de actualización periódico de la directriz.
Las guías se elaboran informadas por la evidencia y desde el Ministerio de Salud nacional se enfoca en favorecer y fortalecer la metodología GRADE. La misma ha sido formalmente acogida para elaborar las guías nacionales de acuerdo a la Guía metodológica antes mencionada. La evidencia local es incluida en el proceso de adaptación y elaboración de GPC.
En la priorización para la elaboración de las GPC y en su propia elaboración, se tiene en cuenta las recomendaciones de la Conitec en cuanto a incorporación de las tecnologías por lo cual existe frecuentemente un grado de concordancia entre las tecnologías recomendadas para su inclusión y los tratamientos establecidos en las GPC. Además, una vez que una TS es incorporada al SUS se pretende monitorear su indicación en las guías de práctica clínica y su correspondencia con las especificaciones de incorporación establecidas (edad de pacientes, estadio de patología, cumplimiento de criterios diagnósticos, tratamientos previos, etc.).
Enlaces para búsqueda de GPC del SUS: https://www.gov.br/saude/pt-br/assuntos/protocolos-clinicos-e-diretrizes-terapeuticas-pcdt
Para mayor información: http://conitec.gov.br/pcdt-em-elaboracao
 Chile
Chile El país cuenta a nivel nacional con una normativa para la elaboración, actualización y adaptación de Guías de Práctica Clínica (GPC) en el país. Es el Ministerio de salud quien tiene un rol rector formal para el correcto desarrollo metodológico de las GPC a través del Departamento de Evaluación de Tecnologías Sanitarias y Salud Basada en Evidencia, en la Unidad de Evidencia Clínica.
El Departamento durante el período 2020-2021 ha desarrollado: 11 Guías de Práctica Clínica y 11 actualizaciones de Guías de Práctica Clínica oncológicas.
El país cuenta con un Manual para la elaboración, actualización y adaptación de GPC: Manual Metodológico – Desarrollo de Guías de Práctica Clínica. Este fue publicado en septiembre de 2014 y tiene como objetivo orientar a los profesionales del Ministerio de Salud, Sociedades Científicas, Universidades y entidades que dirigen el desarrollo de GPC en Chile utilizando la metodología GRADE (Grading of Recommendations Assessment, Development and Evaluation).
Aunque el país no cuenta con una estrategia o política nacional para establecer mecanismos que faciliten la implementación de las GPC en los diferentes niveles de atención en salud, esta se encuentra en proceso de elaboración. Asimismo, aun no se han desarrollado evaluaciones de resultados de la implementación y utilización de las GPC, pero si se cuenta con un plan de actualización de las GPC que así lo requieran. De forma promedio anual, se suelen actualizar alrededor de 20 GPC. Las guías se elaboran informadas por evidencia y desde el año 2014 se ha adoptado la metodología GRADE como estándar para su desarrollo, la cual ha tenido una incremental aceptación por parte de los diferentes actores año a año.
En cada departamento programático de la División de Prevención y Control de Enfermedades del Ministerio de Salud (enfermedades transmisibles, rehabilitación, enfermedades no transmisibles, salud mental, cáncer, entre otros) se evalúa de manera anual que GPC son prioritarias para su elaboración o actualización y posteriormente entregan una priorización para el desarrollo de éstas.
En la priorización para la elaboración de las GPC y en su propia elaboración, se suele tener en cuenta los informes de ETS al igual que la evidencia local. Además luego de realizar una GPC se promueve la evaluación por parte del Departamento de ETS de aquellas TS que no hubieran sido evaluadas anteriormente.
Enlaces para búsqueda de GPC del país: https://diprece.minsal.cl/programas-de-salud/guias-clinicas/
 Costa Rica
Costa Rica Existe a nivel nacional una normativa nacional para la elaboración, adaptación e implementación de guías, y también una estrategia nacional para establecer mecanismos que faciliten la implementación de las GPC en los diferentes niveles . El país no cuenta con un plan formal para actualizar las GPC que así lo requieran o evaluaciones de resultados de la implementación y utilización de las GPC. La Dirección de Servicios de Salud, se encarga de la actualización y elaboración de normativa, se prioriza según necesidades.
Tanto en la priorización para la elaboración de las GPC como en su propia elaboración no se suele tener en cuenta los informes de ETS, por lo tanto no existe una concordancia entre las GPC, los informes de ETS y las TS incorporadas.
 Ecuador
Ecuador La Dirección Nacional de Normatización (DNN) del Ministerio de Salud Pública es la instancia encargada de la generación de Guías de Práctica Clínica (GPC) para su aplicación en el Sistema Nacional de Salud con el objetivo de ofrecer un conjunto de recomendaciones basadas en evidencia científica para la atención de determinada enfermedad, mejorar la atención sanitaria y promover la racionalidad y eficiencia en la elección de las distintas opciones de diagnóstico y tratamiento.
Como parte del proceso de elaboración de guías, la DNN realiza:
Desde 2013, Ecuador genera o adapta Guías de Práctica Clínica y cuenta con una “Metodología para la elaboración de documentos normativos de Salud” actualizada en 2019. Para la elaboración de las GPC se utilizan las metodologías AGREE II y ADAPTE y desde el 2013 el país ha generado 56 GPC sobre diferentes temáticas. Enlace para la búsqueda de GPC: https://www.salud.gob.ec/guias-de-practica-clinica/. Actualmente, la elaboración de GPC esta atravesando una fase de incorporación del sistema GRADE.
Existe un proceso de priorización para la elaboración de las GPC. Los temas priorizados deberán responder al menos a uno de los siguientes parámetros: Plan Nacional de Desarrollo Política Pública Objetivo Sectorial Objetivos Estratégicos o Nacionales de la Autoridad Sanitaria Políticas Nacionales en Salud Modelos, Planes y Estrategias Compromisos Estatales e Institucionales en materia de salud.
En el proceso de priorización de las GPC y en su propia elaboración, se suele tener en cuenta los informes de ETS y sus recomendaciones por lo cual existe frecuentemente una concordancia entre las TS recomendadas y las establecidas en las GPC. Además, luego de la elaboración de una GPC se promueve la evaluación por parte del organismo nacional de ETS de aquellas tecnologías indicadas que no hubieran sido evaluadas anteriormente.
En relación al monitoreo de la implementación de las GPC este procedimiento esta a cargo de cada uno de los subsistemas de salud, así como de monitorear su implementación en su respectiva red de establecimientos de salud. Al momento no se dispone de información sobre el nivel de implementación de las GPC en el MSP y en los otros subsistemas de salud.
 El Salvador
El Salvador El país no cuenta con una normativa nacional y guía para la elaboración y adaptación de GPC pero es el Ministerio de salud quien tiene un rol rector para el desarrollo de las guías y tienen un plan para actualizar las mismas. Tampoco se cuenta con una estrategia nacional para establecer mecanismos que faciliten la implementación de las guías en los diferentes niveles o con evaluaciones de resultados de la implementación y utilización de las GPC.
Las guías se elaboran informadas por la evidencia y desde el Ministerio de Salud nacional la metodología GRADE ha sido formalmente acogida para elaborar las guías. Cada guía tiene una sección metodológica que describe la manera como fue realizada. Se incluye la evidencia local dentro del proceso de adaptación y elaboración de las guías. Además, existe un proceso de priorización para la elaboración de las guías de acuerdo a la carga de enfermedad se priorizan las guías relativas a enfermedades con alta morbimortalidad en el país.
Tanto en la priorización para la elaboración de las GPC y en su propia elaboración, se suele tener en cuenta las recomendaciones de los informes de ETS y los medicamentos de la LIME. Aunque, después de la elaboración de una GPC, no se suele promover la evaluación de las TS indicadas que no hayan sido evaluadas anteriormente.
En el país se cuenta con declaración de conflicto de interés por parte del equipo participante en la elaboración de las GPC.
La elaboración de GPC basadas en la evidencia es un proceso reciente en el país (2 GPC en 2019), se va construyendo y fortaleciendo un equipo metodológico para la adaptación de futuras guías.
Enlaces para búsqueda de GPC del país: http://ins.salud.gob.sv/evidencia-cientifica/
 Guatemala
Guatemala El país no cuenta con una normativa nacional y guía para la elaboración y adaptación de GPC.
Varias estructuras de distintas índoles (Ministerio de Salud, Seguridad Social, aseguradoras privadas, proveedores de salud) desarrollan las guías con estructuras funcionales propias e independientes. Cada institución puede o no tener su manual para la elaboración de GPC. En el caso del IGSS existe el Manual de Normas para la elaboración de Guías de Práctica Clínica Basadas en la Evidencia (2018) a cargo del Departamento de Medicina Preventiva.
Tampoco se cuenta con una estrategia nacional para establecer mecanismos que faciliten la implementación de las guías en los diferentes niveles o con evaluaciones de resultados de la implementación y utilización de las GPC.
En general, las guías se elaboran informadas por la evidencia; sin embargo, hace falta aún fortalecer algunas de las etapas metodológicas y de los procesos de elaboración para que se cumplan todos los criterios aceptados por la OMS. Cada guía suele tener una sección metodológica que describe la manera como fue realizada. En el caso del IGSS se utiliza la metodología AGREE.
Se incluye ocasionalmente evidencia local dentro del proceso de adaptación y elaboración de las guías. No existe un proceso de priorización para la elaboración de las guías de acuerdo a la carga de enfermedad u otros indicadores sanitarios.
En la elaboración de las GPC no se suele tener en cuenta las recomendaciones de los informes de ETS por lo cual rara vez existe un grado de concordancia entre las TS recomendadas y los tratamientos establecidos según las GPC.
En general, no se cuenta con declaración de conflicto de interés por parte del equipo participante en la elaboración de las GPC.
Enlaces para búsqueda de GPC y manuales de los distintos subsectores:
https://www.mspas.gob.gt/descargas-mspas/category/51-guias
https://www.mspas.gob.gt/descargas-mspas/category/49-normas-de-atencion
https://www.mspas.gob.gt/descargas-mspas/category/52-manuales
https://www.mspas.gob.gt/descargas-mspas/category/607-protocolos
https://www.mspas.gob.gt/descargas-mspas/category/608-plan-nacional
https://www.igssgt.org/prevencion/guias-de-practica-clinica-basadas-en-evidencia-gpc-be/guias/
 México
México Existen diferentes estructuras que desarrollan las guías a nivel nacional bajo la supervisión de un ente único. La secretaria de Salud tiene un rol formal para el desarrollo de las guías a través del Centro Nacional de Excelencia Tecnológica en Salud (CENETEC).
En México, a partir del año 2007 surge el Programa Nacional de Guías de Práctica Clínica, bajo la coordinación de la Subsecretaría de Integración y Desarrollo del Sector Salud a través del CENETEC quien conduce la integración sectorial del Catálogo Maestro de Guías de Práctica Clínica como un referente nacional para favorecer la toma de decisiones clínicas y gerenciales basadas en recomendaciones sustentadas en la mejor evidencia científica disponible, teniendo como objetivo reducir la variabilidad de la práctica clínica, así como el uso de intervenciones innecesarias e inefectivas, facilitar el tratamiento de pacientes con el máximo beneficio y el menor riesgo a un costo aceptable.
Para lograr dicho fin, la Dirección de Integración de Guías de Práctica Clínica en conjunto con las instituciones del Sector Salud produce:
– Guías de Práctica Clínica (GPC)
– Metodología para la Integración de Guías de Práctica Clínica
– Talleres de Capacitación en Medicina Basada en Evidencia
Asimismo, la participación del CENETEC como miembro de organismos internacionales permite la colaboración e intercambio de experiencias, de tal forma, que se promueva y eleve la competitividad y calidad de las Guías de Práctica Clínica en un entorno global.
El país cuenta con una Normativa nacional para la elaboración y adaptación de GPC además de contar con una Guía metodológica para la elaboración de las GPC que establece un plan de actualización. En la misma, se establece el proceso de priorización para la elaboración de guías relevantes para el país por medio del método Hanlon y se establecen los estándares y procedimientos definidos para la presentación y valoración de la declaración de los conflictos de interés por parte del equipo participante de la elaboración de las GPC.
A su vez el país ha trabajado en un Plan estratégico sectorial para la implementación de Guías de Práctica Clínica mediante algoritmos de atención clínica y Evaluaciones de resultados de la implementación y utilización de las GPC.
Las guías se elaboran informadas por la evidencia y desde el Ministerio de Salud nacional se enfoca en favorecer y fortalecer la metodología GRADE. A partir del 2015 se adoptó el sistema GRADE para el desarrollo de las GPC, sin embargo no se ha logrado estandarizar en el total de las guías ni su adopción por todas las instituciones desarrolladoras de guías. Respecto a la evidencia local, no siempre se incluye dentro del proceso de elaboración de las guías.
En la priorización para la elaboración de las GPC y en su propia elaboración, se tiene en cuenta las tecnologías sanitarias consideradas para ETS y frecuentemente existe un grado de concordancia entre las tecnologías recomendadas por la ETS y los tratamientos establecidos en las GPC.
Enlaces para búsqueda de GPC del país (Catálogo Maestro de GPC): http://cenetec-difusion.com/gpc-sns/?page_id=5223
 Paraguay
Paraguay El país no cuenta con una normativa nacional para la elaboración e implementación de las GPC. El Ministerio de Salud tiene un rol rector formal para el desarrollo de las GPC. El país ha desarrollado una estrategia nacional para establecer mecanismos que faciliten la implementación de las guías en los diferentes niveles. Aunque no cuenta con evaluaciones de resultados de la implementación y utilización de las GPC.
El Comité de Farmacoterapia dependiente de la Dirección General de Gestión de Insumos Estratégicos y reactivado en 2019 se encuentra abocado a la actualización de las guías nacionales que así lo requieren.
No existe a nivel nacional una guía o estándares y procedimientos definidos para la elaboración de las GPC. Las guías se elaboran informadas por la evidencia, sin embargo hace falta fortalecer algunas de las etapas metodológicas y de los procesos de elaboración para que se cumplan todos los criterios aceptados por la OMS. Si bien se han desarrollado varias GPC con la metodología GRADE aún hace falta avanzar en su institucionalización. La evidencia local se incluye dentro del proceso de adaptación y elaboración de las guías y también existe un proceso de priorización para la elaboración de las guías relevantes del país.
No cuenta el Ministerio con un repositorio público para el fácil acceso de las GPC vigentes en el país.
 Perú
Perú El Ministerio de Salud tiene un rol rector formal para el desarrollo de las GPC en el país. La Dirección de Intercambio Prestacional, Organización y Servicios de Salud es la encargada de tal fin. Para mayor información: https://www.datosabiertos.gob.pe/dataset/direcci%C3%B3n-de-intercambio-prestacional-organizaci%C3%B3n-y-servicios-de-salud
El país cuenta con una normativa nacional y guía para la elaboración y adaptación de GPC aprobada por Resolución Ministerial N° 302-2015-MINSA disponible en: https://selecciondepersonal.fap.mil.pe/media/attachments/2020/11/25/nt-gpc1norma-tecnica-para-elaboracion-de-guias-12.pdf
El país no cuenta con una estrategia o política nacional para establecer mecanismos que faciliten la implementación de las GPC en los diferentes niveles, han realizado algunas evaluaciones o monitoreos de los resultados de la implementación de las GPC pero aún no se encuentran publicados. Tampoco se cuenta con un plan para actualizar las GPC que así lo requieran.
Existen estándares y procedimientos definidos a nivel nacional basados en las mejores evidencias para la elaboración y adaptación de las GPC. La metodología GRADE ha sido formalmente adoptada en la guía metodológica pero en la realidad, si bien existen algunas instituciones que se encuentran hacia el uso de procesos metodológicos más rigurosos como es la metodología GRADE, no son la mayoría y las guías se suelen desarrollar aun mayoritariamente en base a la opinión de los expertos. El Ministerio de Salud tiene intenciones de avanzar formalmente hacia la utilización de la metodología GRADE.
Existe un proceso de priorización para la elaboración de las GPC relevantes para el país. Se cuenta con un instrumento metodológico que incluye criterios relevantes, los cuales son evaluados con una escala cualitativa y cuantitativa. Este instrumento se encuentra aprobado formalmente en el INS y cuenta con un aplicativo virtual para su aplicación.
Si bien en la priorización para la elaboración de las GPC y en su propia elaboración, no se suele tener en cuenta los informes de ETS (no existe una concordancia en la mayoría de los casos), una vez que una TS es incorporada al PMO se pretende monitorear su indicación en las guías de práctica clínica y su correspondencia con las especificaciones de incorporación establecidas (edad de pacientes, estadio de patología, cumplimiento de criterios diagnósticos, tratamientos previos, etc.).
Enlaces para búsqueda de GPC del país: https://web.ins.gob.pe/salud-publica/publicaciones-unagesp/guias-de-practica-clinica
El IETSI-ESSALUD elabora GPC en el marco de lo establecido por el ente rector y son de aplicación obligatoria a nivel nacional dentro del subsector. Además, se ha implementado un procedimiento para monitorizar la adherencia a las recomendaciones de la GPC publicadas por el IETSI, también se tienen implementados procedimientos regulares para la priorización de elaboración de GPC. Finalmente, en las GPC se toma en consideración las ETS elaboradas por el IETSI y solo incluyen en las recomendaciones las tecnologías sanitarias que ya hayan sido incorporadas en los listados o petitorios institucionales. Enlaces para búsqueda de GPC de ESSALUD: http://www.essalud.gob.pe/ietsi/guias_pract_clini.html
Con respecto a UFETS, ha contribuido en la elaboración de tres GPC Tumor óseo de células gigantes irresecable, Tumor neuroendocrino gastroenteropancreático y Leucemia de células vellosas, desarrolladas con metodología GRADE y alineadas a los informes de evaluación de tecnologías sanitarias vigentes.
 República Dominicana
República Dominicana EL Ministerio de Salud tiene un rol rector formal para el desarrollo de las GPC. Es la Unidad de Guías de Práctica Clínica – VIMGC la encargada de elaborar las guías en el país.
El país no cuenta con una normativa nacional sobre las GPC pero sí cuenta con una guía para la elaboración de las GPC a nivel nacional. Además, cuenta con una estrategia nacional para establecer mecanismos que faciliten la implementación de las GPC en los diferentes niveles y algunas evaluaciones de resultados de la implementación y utilización de las GPC. No existe un plan formal para actualizar las guías nacionales que así lo requieren.
Las guías se elaboran informadas por la evidencia y desde el ministerio de salud se enfoca en favorecer y fortalecer la metodología GRADE. Si bien se han desarrollado varias GPC con la metodología GRADE aún hace falta avanzar en su institucionalización. La evidencia local se incluye dentro del proceso de adaptación y elaboración de las guías y también existe un proceso de priorización para la elaboración de las guías relevantes del país.
Enlaces para búsqueda de GPC del país: https://repositorio.msp.gob.do/browse?value=Gu%C3%ADa%20de%20Pr%C3%A1ctica%20Cl%C3%ADnica&type=subject
 Uruguay
Uruguay El país no cuenta con una normativa nacional para la elaboración y adaptación de GPC, ni con una estrategia o política nacional para establecer los mecanismos que faciliten la implementación de las GPC en los diferentes niveles. Sí se dispone de una guía metodológica para la elaboración de las GPC basadas en evidencias; sin embargo, aún se deben fortalecer algunas de las etapas metodológicas y de los procesos de elaboración para cumplir con todos los criterios aceptados por la OMS. Aunque se han desarrollado algunas guías utilizando la metodología GRADE aún se requiere mayor institucionalización. La evidencia local se incluye ocasionalmente en la elaboración de las GPC.
De todas formas, se promueve el empleo de GPC a través de un plan de incentivos para los proveedores de salud que las implementen.
En la priorización y la elaboración de las GPC se tiene en cuenta los informes de ETS, existiendo concordancia entre las TS incluidas en el SNIS y los tratamientos establecidos en las GPC. Una vez que una TS es incorporada al PIAS se pretende monitorear su indicación a través de las guías de práctica clínica (edad de pacientes, estadio de patología, cumplimiento de criterios diagnósticos, tratamientos previos, etc.).
No existe un repositorio público de las GPC que se utilizan en el país, si se pueden encontrar disponibles algunas guías en el sitio web del MSP y FNR. A nivel de los prestadores de salud y sociedades científicas, éstos pueden adaptar GPC internacionales a la práctica clínica o elaborar propias.
 Argentina
Argentina El país cuenta con distintas formas de monitorear las Tecnologías de Salud: Sistemas de Farmacovigilancia, Sistemas de Tecnovigilancia, Servicios de auditoría, y además el subsector de la seguridad social nacional posee un sistema de tutelaje para el seguimiento de nuevas tecnologías.
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) es el efector final de la farmaco y tecnovigilancia, siendo los colegios de profesionales y otras instituciones sus efectores periféricos.
Respecto al Programa Nacional de Seguimiento de Tecnologías Sanitarias Tuteladas dependiente del Ministerio de Salud, el mismo fue creado por Resolución 1380/2020 y se encarga de supervisar la correcta utilización de tratamientos para patologías de baja prevalencia, o que generen un alto impacto en el presupuesto público originado en su alto precio, o que ocasionen incertidumbre respecto de su eficacia y seguridad, ya sea porque reviste calidad de evidencia baja o muy baja, o no se encuentre determinado su costo-efectividad a nivel local.
 Brasil
Brasil El país cuenta con distintas formas de monitorear las Tecnologías de Salud: Información del mundo real (Real World Evidence), Control de dispensación, Registros e Historias Clínicas, Sistema de Farmacovigilancia. No se cuenta con un Sistema de Tecnovigilancia.
El país ha comenzado recientemente a monitorear el desempeño de las tecnologías sanitarias disponibles en el sistema público de salud. El seguimiento de la demanda atendida y el impacto presupuestario real de las tecnologías se realiza en base a información sobre el precio efectivamente practicado en la adquisición de la tecnología, el número de usuarios ya atendidos y en cuidado, el perfil demográfico del sexo y la edad de los pacientes atendidos, la distribución geográfica según zona de residencia y adherencia al tratamiento. Esta información se obtiene a través de las bases de datos de los sistemas de información del Sistema Único de Salud, individualmente por paciente, según un identificador nacional único.
El seguimiento de la eficacia clínica de las tecnologías sanitarias se realiza mediante la actualización de la evidencia científica publicada después de la Incorporación y mediante la realización de estudios primarios con diseño observacional y datos del mundo real. Las enfermedades raras se han priorizado para la realización de estudios primarios, debido a la escasez y la baja calidad de la evidencia de los estudios aleatorizados disponibles y al alto impacto financiero que representan para el presupuesto del sistema de salud. A partir de la consolidación de las iniciativas de seguimiento, se espera que el sistema de salud pueda realizar incorporaciones con acceso gestionado.
 Chile
Chile El país cuenta con distintas formas de monitorear las Tecnologías de Salud: Sistemas de Farmacovigilancia, Servicios de auditoría, Control de dispensación de medicamentos y reportes de servicios farmacéuticos. No hay un desarrollo equivalente para el resto de las Tecnologías de Salud.
El Programa Nacional de Farmacovigilancia evalúa las sospechas de reacciones adversas a medicamentos que le son reportadas. Además, evalúa las publicaciones generadas por agencias reguladoras de medicamentos de otros países, con el fin de analizar el posible riesgo en el uso de medicamentos en el país, emitiendo notas informativas de seguridad que indican recomendaciones y acciones a seguir con respecto de los medicamentos. Este Programa lo lleva acabo el Instituto de Salud Pública de Chile (ISP), que posee autonomía de gestión y está dotado de personalidad jurídica y de patrimonio propio, dependiendo del Ministerio de Salud para la aprobación de sus políticas, normas y planes generales de actividades, así como en la supervisión de su ejecución.
 Costa Rica
Costa Rica El país cuenta con distintas formas de monitorear las Tecnologías de Salud: Sistemas de Farmacovigilancia, Sistemas de Tecnovigilancia, Reportes de servicios farmacéuticos y Control de Dispensación.
 Ecuador
Ecuador El país cuenta con distintas formas de monitorear las Tecnologías de Salud: Control de dispensación de medicamentos, un Sistema Nacional de Farmacovigilancia (SNFV) y un Sistema Nacional de Tecnovigilancia (SNTV) a cargo de la Agencia Nacional de Regulación, Control y Vigilancia Sanitaria (ARCSA). Para mayor información: https://www.controlsanitario.gob.ec/tecnovigilancia-farmacovigilancia/
 El Salvador
El Salvador El país cuenta con un Sistema de Farmacovigilancia para monitorear el desempeño de los medicamentos incorporados en el paquete de beneficios. Al momento no se encuentran institucionalizados otros sistemas de vigilancia. Actualmente se encuentra en elaboración la Norma Técnica de Farmacovigilancia.
El país ha adoptado directrices para las buenas prácticas de prescripción (BPP) y buenas prácticas de farmacia (BPF) de acuerdo con la documentación de OMS/FIP. Además utiliza indicadores para el monitoreo de variables relacionadas con las prácticas de prescripción y dispensación a nivel nacional, aunque estos indicadores no se utilizan para informar el monitoreo de las tecnologías evaluadas por la Unidad de ETS y de aquellas tecnologías contempladas en las guía de práctica (falta articulación).
 Guatemala
Guatemala El país cuenta con un Sistema de Farmacovigilancia, Sistema de Tecnovigilancia y Control de dispensación para monitorear el desempeño de los medicamentos y otras tecnologías sanitarias incorporadas en el paquete de beneficios.
El Programa Nacional de Farmacovigilancia de Guatemala tiene una estructura descentralizada que:
– Integra las actividades que el Ministerio de Salud Pública y Asistencia Social realiza para recoger y elaborar la información sobre eventos adversos o cualquier otro problema relacionado con medicamentos.
– Autoriza el desarrollo de las investigaciones clínicas multicéntricas, públicas y privadas que alcancen estándares internacionales en la experimentación con Humanos.
El país no ha adoptado directrices para las buenas prácticas de prescripción (BPP) y buenas prácticas de farmacia (BPF) de acuerdo con la documentación de OMS/FIP. Además, no suele utilizar indicadores para el monitoreo de variables relacionadas con las prácticas de prescripción y dispensación a nivel nacional.
 México
México El encargado de organizar a nivel nacional los programas de Farmacovigilancia y Tecnovigilancia, y de la vigilancia post-comercialización es el Centro Nacional de Farmacovigilancia de la COFEPRIS.
La normatividad, guías, lineamientos y requerimientos para cumplir con ambos programas, disponibles en: https://www.gob.mx/cofepris/documentos/guias-lineamientos-y-requerimientos-de-farmacovigilancia
La Norma Oficial Mexicana NOM-240-SSA1-2012, Instalación y operación de la tecnovigilancia, se encuentra disponible en: http://dof.gob.mx/nota_detalle.php?codigo=5275834&fecha=30/10/2012
 Paraguay
Paraguay El país cuenta con un Sistema de Farmacovigilancia, reportes de servicios farmacéuticos, y los registros médicos e historias clínicas para el monitoreo de los Medicamentos que se dispensan y comercializan. El desempeño de las otras Tecnologías de Salud se monitorea por medio de un Sistema de Tecnovigilancia, servicios de auditoría y Registros/Historias clínicas.
El país no utiliza indicadores para el monitoreo de variables relacionadas con las prácticas de prescripción y dispensación de medicamentos a nivel nacional.
Cuando se incorpora una TS en el plan nacional de beneficios se monitorea que su indicación en las GPC se corresponda con las especificaciones de incorporación establecidas en la decisión de su incorporación.
 Perú
Perú El país cuenta con distintas formas de monitorear las Tecnologías de Salud: Sistemas de Farmacovigilancia, Sistema de Tecnovigilancia, Servicios de auditoría, Control de dispensación y reportes de servicios farmacéuticos. Es de interés la creación de un Sistema de Tecnovigilancia.
El país cuenta con un Sistema Peruano de Farmacovigilancia y Tecnovigilancia liderado por la DIGEMID. Este Sistema está conformado por los Centros de Referencia Regional del MINSA y Centros de Referencia Institucional (EsSalud, Fuerzas Armadas, Fuerzas Policiales). El Sistema Peruano de Farmacovigilancia fue implementado por la DIGEMID en 1999, con la finalidad de vigilar y evaluar la seguridad de los productos farmacéuticos, dispositivos médicos y productos sanitarios, para la adopción de medidas que permitan prevenir y reducir los riesgos y conservar sus beneficios. Desde el año 2020, el Perú forma parte del Sistema Internacional de Farmacovigilancia conducido por la Organización Mundial de la Salud a través del Centro de Monitoreo de Uppsala (UMC).
La organización y funcionamiento del Sistema Peruano de Farmacovigilancia y Tecnovigilancia se basa en normativas nacionales dentro de las que se destacan
Existe un proceso de notificación de sospechas de reacciones adversas a medicamentos (SRAM) y sospechas de incidentes adversos a dispositivos médicos (SIADM) como piedras angulares de la Farmacovigilancia y Tecnovigilancia. Si bien aún se mantiene la notificación en físico a través de los formatos de notificación de SRAM y SIADM, actualmente se viene haciendo uso de la herramienta virtual VIGIFLOW como herramienta de notificación y evaluación de SRAM. La evaluación de causalidad de realiza con el algoritmo de Karch y Lasagna modificado. En el caso de las notificaciones de SIADM, como parte de las actividades de Tecnovigilancia, aún no existe un sistema de notificación virtual.
En ESSALUD es parte del Sistema Peruano de Farmacovigilancia y Tecnovigilancia a través del se cuenta con el Centro de Referencia Institucional de Farmacovigilancia y Tecnovigilancia (CRI-EsSalud) responsable de conducir el Sistema de FV y TV de EsSalud. .EsSalud cuenta con su propia directiva del Sistema de FV y TV disponible en http://www.essalud.gob.pe/ietsi/farmacov_normatividad.html
Dentro sus funciones está la gestión y evaluación de SRAM y SIADM, la implementación de Farmacovigilancia intensiva/Tecnovigilancia intensiva para conocer mejor el perfil de seguridad de los medicamentos y dispositivos médicos en el mundo real, la generación e implementación de propuestas para gestionar riesgos (prevenir/minimizar riesgos) a través de comunicación de riesgos, generación de recomendaciones técnicas sobre seguridad de PF y DM, identificación de señales (eventos raros y no conocidos) y próximamente la implementación de farmacoepidemiología. Para mayor información: http://www.essalud.gob.pe/ietsi/farmacov_tecnov.html
Por su parte, la UFETS, ha realizado tres evaluaciones del mundo real sobre medicamentos:
– Evaluación de Tecnología Sanitaria Revisión Rápida N° 008-2021 – Topotecan en cáncer ovario platino resistente que ha progresado a una primera línea de tratamiento. https://portal.inen.sld.pe/wp-content/uploads/2021/04/Revisi%C3%B3n-r%C3%A1pida-N-008-2021.pdf
– Evaluación de Tecnología Sanitaria Revisión Rápida N° 011-2021 – Interferón alfa en el tratamiento adyuvante de pacientes con melanoma cutáneo operado. https://portal.inen.sld.pe/wp-content/uploads/2021/08/ETS-N%C2%B0-11.pdf
– Denosumab en el tratamiento de pacientes con tumor óseo de células gigantes irresecables.
Además, la Dirección de Medicina del INEN, ha realizado una presentación de resultados de eficacia medicamentos no PNUME – Departamento de Oncología médica.
 República Dominicana
República Dominicana El país cuenta con un Sistema de Farmacovigilancia, reportes de servicios farmacéuticos, y los registros médicos e historias clínicas para el monitoreo de los Medicamentos que se dispensan y comercializan. Es de interés avanzar también con un Sistema de Tecnovigilancia.
Cuando se incorpora una TS en el plan nacional de beneficios de la Seguridad Social se monitorea que su indicación en las GPC se corresponda con las especificaciones de incorporación establecidas en la decisión de su incorporación.
 Uruguay
Uruguay El país cuenta con distintas formas de monitorear las Tecnologías de Salud: Sistemas de Farmacovigilancia, Tecnovigilancia, Control de dispensación, Registros e Historias Clínicas, Información del mundo real (Real World Evidence) para las prestaciones que financia el FNR.
 Argentina
Argentina El país cuenta con un proceso de priorización para definir los medicamentos y otras tecnologías sanitarias que serán evaluadas a nivel nacional.
Este proceso tiene en cuenta las tecnologías sanitarias consideradas en las GPC.
Para mayor información: https://www.argentina.gob.ar/salud/conetec/documentos-tecnicos
 Brasil
Brasil Se realizan todos los pedidos de evaluación para incorporación, exclusión o cambio de tecnologías dentro del SUS, por lo tanto, no hay un proceso de priorización para definir los medicamentos y otras tecnologías sanitarias que serán evaluadas a nivel nacional.
Según el ordenamiento jurídico vigente, la Conitec actúa siempre que se le exige formalmente. Además, existe un proceso común para la submisión: no solo los productores, sino otros actores pueden solicitar la evaluación de una tecnología sanitaria, por ejemplo, grupos de pacientes.
En este sentido, las solicitaciones se atienden desde el momento en que los documentos presentados a la Secretaría Ejecutiva son considerados en conformidad y por orden de llegada. Además, las actualizaciones de las GPC se priorizan cada dos años con las áreas finalistas como lo exige la ley.
La única excepción se refiere a los casos de emergencia de salud pública de importancia nacional, cuando el Ministro de Estado de Salud puede determinar que el proceso sea evaluado en un régimen prioritario dentro de 60 días.
 Chile
Chile El país cuenta con un proceso de priorización para definir los medicamentos y otras tecnologías sanitarias que serán evaluadas a nivel nacional.
La metodología de priorización de TS a evaluar para el caso de LRS, empieza con la recepción de las solicitudes desde la ciudadanía y de la División de Prevención y Control de Enfermedades del Ministerio de Salud, estas tecnologías son evaluadas para identificar si cumplen con los criterios de inclusión indicados en el reglamento. En el caso de su cumplimiento, éstas son evaluadas formalmente en el proceso de evaluación de la LRS.
Para intervenciones a ser evaluadas en otros mecanismos de cobertura, no existe un proceso formal de priorización de medicamentos y otras tecnologías sanitarias que serán evaluadas. Sin embargo, se analizan preferentemente solicitudes emanadas de sociedades científicas o aquellas ya incorporadas en recomendaciones de GPC.
 Costa Rica
Costa Rica El país no cuenta con un proceso de priorización para definir los medicamentos y otras tecnologías sanitarias que serán evaluadas a nivel nacional.
 Ecuador
Ecuador El país no cuenta con un proceso de priorización para definir los medicamentos y otras tecnologías sanitarias que serán evaluadas a nivel nacional.
 El Salvador
El Salvador El país no cuenta con un proceso de priorización para definir los medicamentos y otras tecnologías sanitarias que serán evaluadas a nivel nacional.
 Guatemala
Guatemala En el IGSS por medio de la Dirección Terapéutica Central se encuentran en desarrollo la formalización de los criterios de priorización de las TS a evaluar.
 México
México El Consejo de Salubridad General, a través de la Comisión Interinstitucional del Cuadro Básico y Catálogo de Insumos de Sector Salud (CICBCISS) establece los procesos de integración de Compendio Nacional de Insumos para la Salud (CNIS), que cuenta con procesos definidos para la actualización del mismo. Las solicitudes de actualización se reciben en el CSG conforme a lo estipulado en el artículo 36 del Reglamento Interior de la CICBCISS y se turnan a la Dirección General Adjunta de Priorización, que a su vez funge como Secretariado Técnico de la Comisión Interinstitucional, con la finalidad de revisar y valorar el contenido de las mismas. Cuando se determina que una solicitud cumple cabalmente con los requisitos establecidos en el reglamento citado, se informa a los solicitantes y se envía al Comité correspondiente para su evaluación.
Los comités deciden en qué orden se evalúan las solicitudes de actualización. Dentro del proceso de evaluación de cada institución, entre ellas el CENETEC, no se cuenta con un mecanismo formal y explícito de priorización y dependerá de las propias necesidades de la Institución.
 Paraguay
Paraguay El país no cuenta con un proceso formal de priorización para definir las tecnologías sanitarias que serán evaluadas a nivel nacional. No se tienen en cuenta las Tecnologías Sanitarias consideradas en las GPC nacionales para ser priorizadas.
 Perú
Perú El país no cuenta con un proceso formal de priorización para definir los medicamentos y otras tecnologías sanitarias que serán evaluadas a nivel nacional.
– La UFETS, en su MAPRO cuenta con el procedimiento “Identificación y Priorización de las Tecnologías Sanitarias a evaluar».
 República Dominicana
República Dominicana El país no cuenta con un proceso de priorización para definir las tecnologías sanitarias que serán evaluadas a nivel nacional.
 Uruguay
Uruguay El país aún no cuenta con un proceso sistematizado de priorización para definir los medicamentos y otras tecnologías sanitarias que serán evaluadas a nivel nacional.
La priorización de tecnologías a evaluar es responsabilidad de quien solicita la evaluación de estas. A nivel interno de la Agencia de Evaluación de Tecnologías Sanitarias (AETSU), se ha asignado la capacidad de trabajo en un 50% para el MSP y la distribución restante a quienes los soliciten, de acuerdo con la llegada de la solicitud.
 Argentina
Argentina La Agencia de Regulación del país es la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), cuyo papel en materia regulatoria es muy relevante. Es un organismo descentralizado que depende del Ministerio de Salud del país. La ANMAT controla y garantiza que los medicamentos, alimentos y dispositivos médicos posean eficacia, seguridad y calidad. Para ello, lleva adelante los procesos de autorización, registro, normatización, vigilancia y fiscalización de estas tecnologías.
Desde la ANMAT se cuenta con diversos sistemas de vigilancia: Farmacovigilancia, Tecnovigilancia, Vigilancia alimentaria, Cosmetovigilancia, Domivigilancia y Productos ilegítimos.
Acceso a las normativas vigentes que regulan la actividad de la ANMAT: http://www.anmat.gov.ar/webanmat/legislacion.asp
 Brasil
Brasil La Agencia de Regulación Sanitaria del país es la Agencia Nacional de Vigilancia Sanitaria -Anvisa. Creada por Ley N ° 9.782 de 26 de enero de 1999, es un ente autárquico de régimen especial dependiente del Ministerio de Salud de Brasil. Su objetivo es «promover la protección de la salud de la población, a través del control sanitario de la producción y consumo de productos y servicios sujetos a vigilancia sanitaria, incluyendo los ambientes, procesos, insumos y tecnologías relacionados con ellos, así como los puertos de control, aeropuertos, fronteras y zonas francas».
Para acceder al Sistema Nacional de Vigilancia Sanitaria y al Sistema de Farmacovigilancia: https://www.gov.br/anvisa/pt-br/assuntos/snvs ; http://portal.anvisa.gov.br/vigimed
Acceso a las normativas vigentes que regulan la actividad de la Anvisa: https://www.gov.br/anvisa/pt-br/setorregulado
 Chile
Chile La Agencia de Regulación del país es el Instituto de Salud Pública de Chile (ISP).
El Instituto de Salud Pública de Chile (ISP) es un Servicio público, que posee autonomía de gestión y está dotado de personalidad jurídica y de patrimonio propio, dependiendo del Ministerio de Salud para la aprobación de sus políticas, normas y planes generales de actividades, así como en la supervisión de su ejecución. El Instituto de Salud Pública de Chile es el organismo de referencia del Estado, que promueve y protege la salud de la población, fortaleciendo el control sanitario a través de la vigilancia, autorización, fiscalización, investigación y transferencia tecnológica, cumpliendo todo ello, con altos estándares de calidad y excelencia.
Acceso a las normativas vigentes reguladas por el ISP: https://www.ispch.cl/resoluciones/
 Costa Rica
Costa Rica La Agencia de Regulación del país es el propio Ministerio de Salud de Costa Rica, a través de la Dirección de Regulación de Productos de Interés Sanitario.
Su objetivo consiste en garantizar la calidad, seguridad, eficacia e inocuidad de los productos de interés sanitario que afectan directamente la salud de las personas, así como los establecimientos relacionados con éstos, mediante la aplicación de procesos de normalización, registro y control, con el fin de contribuir a la protección y mejoramiento de la salud de las personas.
Registro de Productos de interés sanitario: https://www.ministeriodesalud.go.cr/index.php/tramites-ms/registro-de-productos-de-interes-sanitario-ms
Para mayor información regulatoria sobre autorizaciones y certificaciones: https://www.ministeriodesalud.go.cr/index.php/tramites-ms/autorizaciones-y-certificados
 Ecuador
Ecuador La Agencia de Regulación del país es la Agencia Nacional de Regulación, Control y Vigilancia Sanitaria (ARCSA), organismo adscrito al MSP, es la instancia técnica encargado de la regulación, control técnico y vigilancia sanitaria de productos de uso y consumo humano; así como de los establecimientos sujetos a vigilancia y control sanitario establecidos en la Ley Orgánica de Salud y demás normativa aplicable, exceptuando aquellos de servicios de salud públicos y privados (D.E. 1290, Art. 9).
La autorización de mercado en el país esta sujeta a la obtención del “Registro Sanitario”, mismo que garantiza la calidad, seguridad y eficacia de los medicamentos u otros que se comercializan en Ecuador; dependiendo del origen del producto farmacológico se han definido diferentes normativas que tienen como objeto establecer los procesos y normas para controlar y vigilar su comercialización.
Acceso a las normativas vigentes que regulan la actividad de la ARCSA: https://www.controlsanitario.gob.ec/documentos-vigentes/ ; https://www.salud.gob.ec/tramites-requisitos-reglamentos-y-directrices-para-la-obtencion-del-registro-sanitario-arcsa/
 El Salvador
El Salvador La Agencia de Regulación del país es la Dirección Nacional de Medicamentos y Productos Sanitarios (DNM).
La DNM en El Salvador es la entidad autónoma y técnica encargada de salvaguardar la salud de la población mediante la regulación y vigilancia de los productos farmacéuticos, cosméticos, higiénicos, químicos, dispositivos médicos y materias primas; para garantizar su calidad, seguridad, accesibilidad y eficacia.
Acceso a las normativas vigentes que regulan la actividad de la DNM: https://www.medicamentos.gob.sv/index.php/es/normativa-m
 Guatemala
Guatemala La Agencia de Regulación del país es el Departamento de Regulación y Control de Productos Farmacéuticos y Afines s Sanitarios (DRCPFA), dependiente del Ministerio de Salud Pública y Asistencia Social.
Los registros sanitarios vigentes se pueden consultar en el siguiente enlace: https://medicamentos.mspas.gob.gt/index.php/consultas/registros-vigentes
 México
México La Agencia de Regulación del país es la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS), es un organismo desconcentrado que depende de la Secretaría de Salud, fue creada el 5 de julio de 2001 mediante Decreto presidencial y desde el 19 de agosto de 2020, está adscrita a la Subsecretaría de Prevención y Promoción de la Salud. La misión de la COFEPRIS es proteger a la población contra riesgos a la salud provocados por el uso y consumo de bienes y servicios, insumos para la salud, así como por su exposición a factores ambientales y laborales, la ocurrencia de emergencias sanitarias y la prestación de servicios de salud mediante la regulación, control y prevención de riesgos sanitarios.
Su ámbito de competencia es muy amplio, dentro de sus atribuciones se encuentran la regulación, control y fomento sanitario, de acuerdo a lo establecido en el Artículo 17 bis de la Ley General de Salud, en materia de:
Según Reglamento de la COFEPRIS (2004), la misma está conformada por Órganos (cuatro consejos) y Unidades Administrativas (cinco comisiones, dos coordinaciones y una secretaría general):
Órganos:
La normatividad vigente que regula la actividad de la COFEPRIS se encuentra disponible en: https://www.gob.mx/cofepris/acciones-y-programas/marco-juridico-de-la-cofepris?state=published
 Paraguay
Paraguay La Dirección Nacional de Vigilancia Sanitaria (DINAVISA) es un organismo autárquico, competente en materia de regulación, control, fiscalización y vigilancia de medicamentos y productos sanitarios.
Acceso a las normativas vigentes que regulan la actividad de Dirección Nacional de Vigilancia Sanitaria: mspbs.gov.py/dnvs
 Perú
Perú La Agencia de Regulación del país es la Dirección General de Medicamentos Insumos y Drogas (DIGEMID). Es un órgano de línea del Ministerio de Salud, creado con el Decreto Legislativo Nº 584 del 18 de Abril del año 1990. La DIGEMID es la Autoridad Nacional responsable de garantizar la eficacia, seguridad y calidad de los productos farmacéuticos, dispositivos médicos y productos sanitarios, contribuyendo con el acceso y uso racional de los mismos en beneficio de la salud de la población.
 República Dominicana
República Dominicana La Dirección General de Medicamentos, Alimentos y Productos Sanitarios (DIGEMAPS), es el organismo competente en materia de regulación, control, fiscalización y vigilancia de medicamentos, productos sanitarios, alimentos, bebidas, cosméticos, productos de higiene personal, del hogar y para procesos industriales, tecnologías y materiales de uso humano, que se consumen o utilizan en la prestación de los servicios de salud y/o en la alimentación, así como también del control de los establecimientos, actividades y procesos que se derivan de la materia.
 Uruguay
Uruguay El Ministerio de Salud Pública (MSP) de Uruguay es quien autoriza el ingreso al mercado de las tecnologías a nivel país. Ejerce la función a través del Área de Evaluación Sanitaria, cuyo objetivo principal es proteger y promover la salud de la población participando en la generación de políticas de salud, estableciendo normas, controles y procesos, a fin de garantizar la seguridad sanitaria y el acceso oportuno a productos y servicios de salud.
Acceso a las normativas vigentes que regulan la actividad: https://www.gub.uy/ministerio-salud-publica/evaluacion-sanitaria



